![]() (g)
(g)
![]() (g)+H2(g) △H
(g)+H2(g) △H
|
化学键 |
C—H |
C—C |
C=C |
H—H |
|
键能/kJ•mol-1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=。
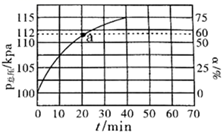
①请用化学平衡理论解释通入大量水蒸气的原因。
②平衡时,p(H2O)= kPa,平衡常数Kp=kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气) , k正、k逆分别为正、逆反应速率常数。计算a处的 =。
i.C6H5-CH=CH2(g)+HBr(g) C6H5-CH2CH2Br(g)
ii.C6H5-CH=CH2(g)+HBr(g) C6H5-CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
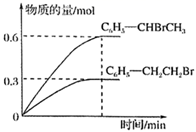
①600℃时,反应ii的化学平衡常数Kii=。
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将 (填“正向”“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是 (填编号)。
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变