
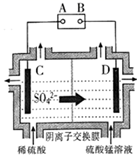
 C . 做SO2与NaOH溶液的喷泉实验
C . 做SO2与NaOH溶液的喷泉实验  D . 用NaOH标准溶液滴定锥形瓶中的盐酸
D . 用NaOH标准溶液滴定锥形瓶中的盐酸 
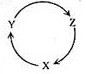
| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| 现象或操作 | 结论 | |
| A | 相同条件下,分别测量0.1 mol•L-1和0.01 mol•L-1醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 将H2O2溶液滴加到酸性KMnO4溶液中,溶液褪色 | H2O2具有氧化性 |
| C | 常温下将大小相同的铝片分别加入到浓硝酸和稀硝酸中,浓硝酸比稀硝酸反应更剧烈 | 反应物浓度越大,反应速率越快 |
| D | 向碘水中加入CCl4振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
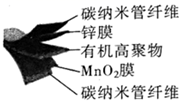
①上述物质中,涉及元素形成简单离子半径由大到小的顺序是。
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因。
③Na2SO3溶液中各离子浓度由大到小的顺序是。
④棉织物用氯气漂白后,加入Na2S2O3除去余氯时生成SO ,写出该反应的离子方程式。若反应中生成2molSO
,则转移电子 mol。
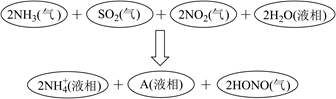
请判断A是 (填化学符号)。
[查阅资料]雾霾颗粒样品中可能含有SO 、CO
、SO
、HCO
、NO
、Cl-、Br-及一种常见阳离子,现进行如图实验:
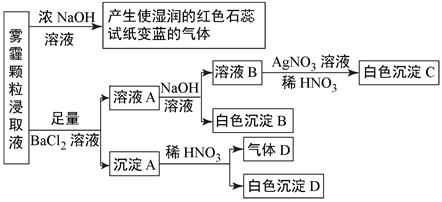
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是,肯定没有的离子是。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有 (填化学式)。
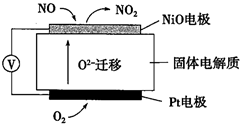
①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出Pt电极的电极反应式。
③写出NiO电极的电极反应式。
![]() (g)
(g)
![]() (g)+H2(g) △H
(g)+H2(g) △H
|
化学键 |
C—H |
C—C |
C=C |
H—H |
|
键能/kJ•mol-1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=。
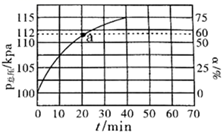
①请用化学平衡理论解释通入大量水蒸气的原因。
②平衡时,p(H2O)= kPa,平衡常数Kp=kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)
③反应速率v=v正-v逆=k正·p(乙苯)-k逆·p(苯乙烯)·p(氢气) , k正、k逆分别为正、逆反应速率常数。计算a处的 =。
i.C6H5-CH=CH2(g)+HBr(g) C6H5-CH2CH2Br(g)
ii.C6H5-CH=CH2(g)+HBr(g) C6H5-CHBrCH3(g)
600℃时,向3L恒容密闭容器中充入1.2molC6H5-CH=CH2(g)和1.2molHBr(g)发生反应,达到平衡时C6H5-CH2CH2Br(g)和C6H5-CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
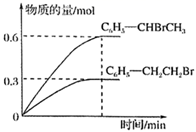
①600℃时,反应ii的化学平衡常数Kii=。
②反应平衡后,若保持其他条件不变,向该容器中再充入1molC6H5-CH2CH2Br(g),则反应ii将 (填“正向”“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,可以判断反应已达到平衡状态的是 (填编号)。
A.容器内混合气体的密度不再改变
B.C6H5-CH2CH2Br(g)的生成速率与C6H5-CHBrCH3(g)的分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
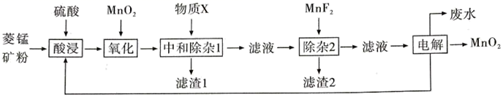
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
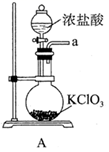
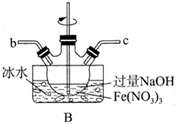
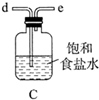
查阅资料:
① 为紫色固体,微溶于
溶液,具有强氧化性,在酸性或中性溶液中快速产生
,在碱性溶液中较稳定。
② 与
溶液在20℃以下反应生成
,在较高温度下则生成
。
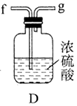
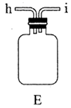
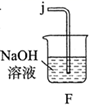
①滴定时选用的指示剂是,滴定终点的现象是。
②制得粗 的纯度是。