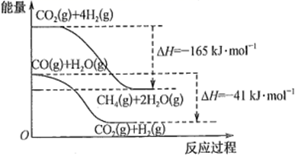
写出CO(g)和H2(g)生成CH4(g)和H2O(g)的热化学方程式。
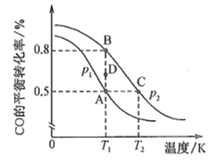
①该反应的∆H(填“>”“<”或“=”)0。
②A、B、C三点平衡常数KA . KB、KC的大小关系为。压强p1 (填“>”“<”或“=”,下同)p2 , 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正v逆。
③若容器容积不变,则下列措施可提高CO平衡转化率的是(填字母)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充人2molCO和4molH2 , 在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=mol∙L-1∙min-1;平衡常数K =(填数值)。
微信扫码预览、分享更方便