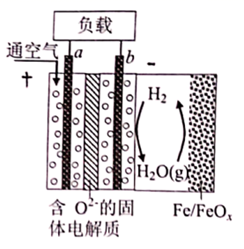
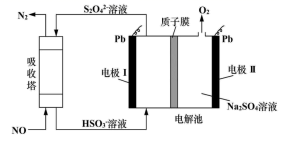
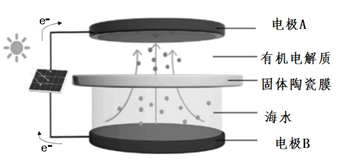
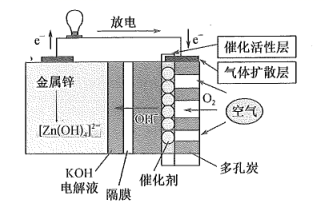
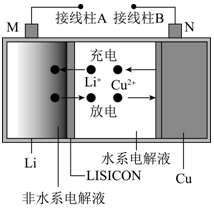
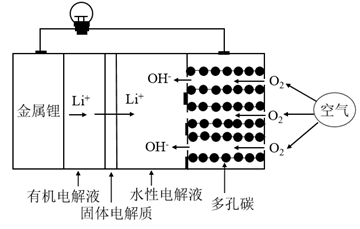
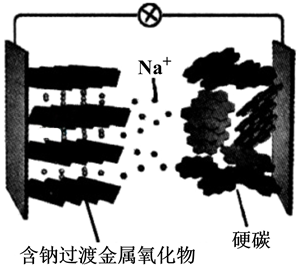

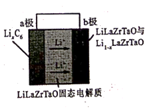
(电池总反应为: LixC6+LisxLaZrTaO LiLaZrTaO+6C)
①该温度下,若向同容积的另一容器中投入N2、H2、NH3 , 其浓度均为2mol/L,则此时v正v逆(填“大于”或“小于”或“等于”)。
②在此温度下,若起始向一个固定容积为1L的密闭容器中充入4molN2和12molH2 , 则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为。
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.58 | 0.50 | 0.50 |
已知该反应V正(NO2)=K1·c2(NO2),V逆(N2O4)= K2·c(N2O4)其中k1、k2为速率常数,则373K时, =。
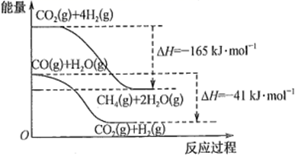
写出CO(g)和H2(g)生成CH4(g)和H2O(g)的热化学方程式。
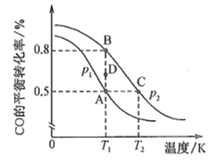
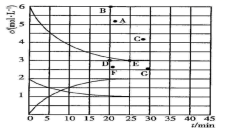
①该反应的∆H(填“>”“<”或“=”)0。
②A、B、C三点平衡常数KA . KB、KC的大小关系为。压强p1 (填“>”“<”或“=”,下同)p2 , 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正v逆。
③若容器容积不变,则下列措施可提高CO平衡转化率的是(填字母)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
④在2L恒容密闭容器中充人2molCO和4molH2 , 在p2和T1条件下经10min达到平衡状态。在该条件下,v(H2)=mol∙L-1∙min-1;平衡常数K =(填数值)。
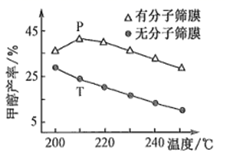
已知:
甲烷直接将 还原为
的热化学方程式为。
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有(写出一种即可)。
②此条件下达到平衡时,计算该反应的平衡常数 。
①常温下,相同浓度的 、
溶液中pH较大的是溶液。
②常温下, 显性(填“酸”“碱”或“中”),判断的理由是: (通过计算说明)。
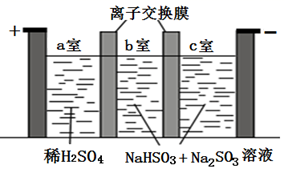
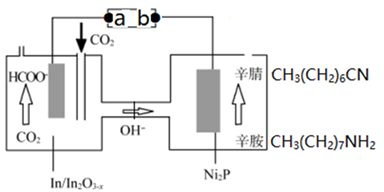
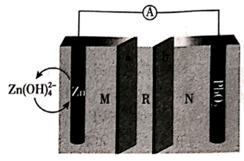
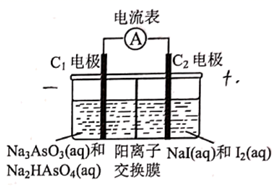
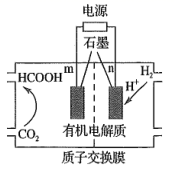
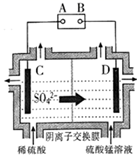
① 从电解槽的(填字母代号)口流出。
②写出阴极的电极反应式:。
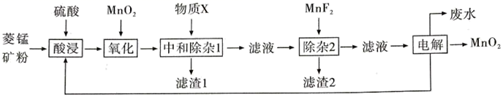
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
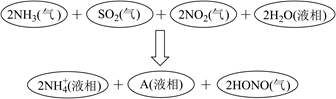
请判断A是 (填化学符号)。
[查阅资料]雾霾颗粒样品中可能含有SO 、CO
、SO
、HCO
、NO
、Cl-、Br-及一种常见阳离子,现进行如图实验:
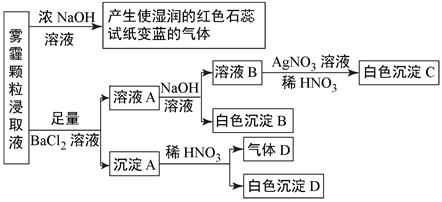
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是,肯定没有的离子是。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有 (填化学式)。
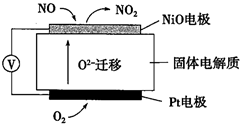
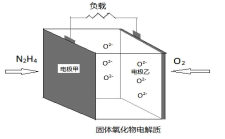
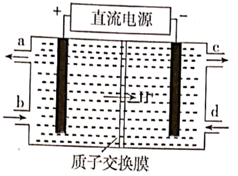
①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出Pt电极的电极反应式。
③写出NiO电极的电极反应式。