
请回答下列问题:
A 粗盐没有完全溶解 B 除杂过程中有NaCl生成
C 蒸发时水分没有蒸干 D 称量精盐时药品和砝码的位置放反了,且使用了游码
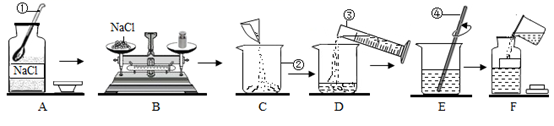
①操作A中的不正确是。
②配制10g质量分数为15%的氯化钠溶液,所需氯化钠的质量为g。
③对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有(填字母)。
A 称量氯化钠时只在药品端垫纸片 B 量取水的体积时,仰视读数
C烧杯事先用水润洗过,内壁有水残留 D装瓶时,有少量溶液洒出
④把10g质量分数为15%的氯化钠溶液稀释成质量分数为5%的氯化钠溶液,需要水的质量是g,该实验的操作步骤为:计算、、混匀等。