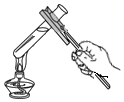
 B . 稀释浓硫酸
B . 稀释浓硫酸 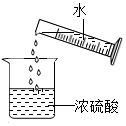 C . 实验室制取并收集少量氢气
C . 实验室制取并收集少量氢气 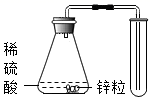 D . 检查装置的气密性
D . 检查装置的气密性 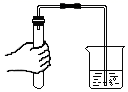


| 选项 | 实验目的 | 实验方案 |
| A | 检验CaCl2溶液中混有少量盐酸 | 取样滴加适量AgNO3溶液观察是否产生沉淀 |
| B | 比较铜和银的金属活动性 | 将铜片和银片放入硫酸亚铁溶液中 |
| C | 鉴别NH4Cl和(NH4)2SO4 | 加入熟石灰研磨,闻气味 |
| D | 探究燃烧需要可燃物 | 用棉花分别蘸酒精和水,放在酒精灯火焰上加热片刻,观察现象 |
| 组别 | 溶液中检验出的离子 |
| A | K+、Na+、OH-、 |
| B | Ba2+、Na+、Cl-、OH- |
| C | Cu2+、Mg2+、 |
| D | H+、 |
 用等质量、等浓度的双氧水分别制取氧气
B .
用等质量、等浓度的双氧水分别制取氧气
B .  将浓盐酸露置在空气中一段时间
C .
将浓盐酸露置在空气中一段时间
C .  向一定质量的稀盐酸中逐滴加入氢氧化钙溶液
D .
向一定质量的稀盐酸中逐滴加入氢氧化钙溶液
D .  电解水实验中,生成的氢气和氧气之间的质量关系
电解水实验中,生成的氢气和氧气之间的质量关系


①植物的光合作用需要吸收空气中的水和,可有效减缓温室效应。
②酸雨不利于植物生长。煤燃烧产生的进入大气后可形成“硫酸型”酸雨。
①“赤潮”和“水华”是水中氮、磷等含量过多导致藻类大量繁殖,鱼类等死亡。这里的“氮、磷”指的是(填“单质”、“化合物”或“元素”);
②下列关于水的说法正确的是(填字母)。
a 工业废水需经处理达标后才可排放
b 为保护好水资源,禁止使用化肥和农药
c 天然水只要通过处理后变清即可饮用
d 为了改善水质可向其中加入大量的净水剂和消毒剂
①目前未计入空气污染指数监测项目的有(填字母)。
a 一氧化碳 b 二氧化氮 c 可吸入颗粒物 d 稀有气体
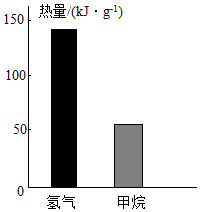
②氢气和甲烷都是清洁能源充分燃烧1g氢气和甲烷释放的热量如图所示,与甲烷相比,氢气作为燃料的优点是,而日常生活中使用的燃料,更多的是以甲烷为主要成分的天然气,原因是。
③硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收: ,X的化学式为。
①人类冶炼和使用金属铝的时间较晚,可能是因为(填字母)。
a地壳中铝元素含量少 b冶炼铝的技术要求高
②用铝锂合金可以制造“神舟号”航天飞船的一些部件。其中铝锂合金属于(选填“合成材料”或“金属材料”)。
③用砂纸去除铝片表面的氧化膜。将其浸入硫酸铜溶液中,一段时间后观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。由此推断硫酸铜溶液中的阳离子有(填离子符号)。
④原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由14个铝原子构成其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号:。



①发生装置应选用(填字母)。
②KCl的溶解度曲线如上图所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解。至少应加入该温度下蒸馏水的体积约mL。
③对溶解所得混合物进行过滤,过滤时需要将圆形滤纸折叠处理。下列滤纸折叠过程图示中,正确的是(选填字母)

④滤渣经处理得MnO2 , 从滤液中获得KCl晶体的最佳方法是。

请回答下列问题:
A 粗盐没有完全溶解 B 除杂过程中有NaCl生成
C 蒸发时水分没有蒸干 D 称量精盐时药品和砝码的位置放反了,且使用了游码
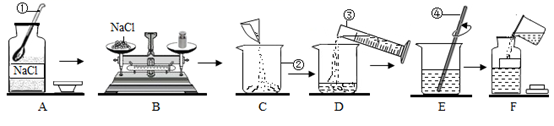
①操作A中的不正确是。
②配制10g质量分数为15%的氯化钠溶液,所需氯化钠的质量为g。
③对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有(填字母)。
A 称量氯化钠时只在药品端垫纸片 B 量取水的体积时,仰视读数
C烧杯事先用水润洗过,内壁有水残留 D装瓶时,有少量溶液洒出
④把10g质量分数为15%的氯化钠溶液稀释成质量分数为5%的氯化钠溶液,需要水的质量是g,该实验的操作步骤为:计算、、混匀等。