|
| 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.6 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
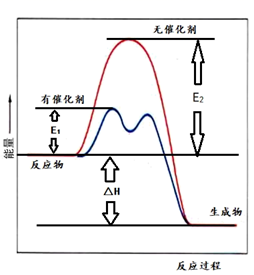
从表中数据分析,工业上采取400℃~500℃、1MPa条件下合成SO3的原因是。在T℃、1MPa条件下,SO2的平衡转化率为x,压强平衡常数Kp=(写出计算式即可)。(以分压代替物质的量浓度,分压=总压×物质的量分数)。
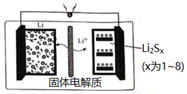
电池充电时,与电源负极所连电极发生的电极反应为,在电池放电时,电池右边电极依次发生Li2S8→Li2S6→Li2S4→Li2S2→Li2S系列转化。若放电前,图右边电极中Li2Sx只有Li2S8 , 放电后生成产物Li2S、Li2S2物质的量之比为6:1,则1mol Li2S8反应得到的电子数为。