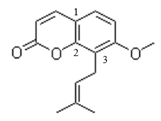
| 选项 | 实验方案 | 实验目的 |
| A | 向含白色ZnS的悬浊液中滴入几滴CuSO4溶液,产生黑色沉淀 | 证明Ksp(ZnS)>Ksp(CuS) |
| B | 将含有少量SO2杂质的CH2=CH2气体缓慢通过足量的酸性KMnO4溶液 | 除去CH2=CH2中的SO2 |
| C | 向Al2(SO4)3溶液中加入过量氨水,然后过滤、洗涤沉淀,再灼烧沉淀 | 制取Al(OH)3 |
| D | 将FeCl3饱和溶液置于蒸发皿中加热蒸干 | 制取无水FeCl3 |

下列说法错误的是( )
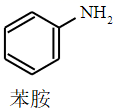 +CH3COOH
+CH3COOH
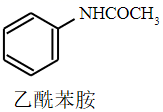 +H2O
+H2O
乙酸、苯胺、乙酰苯胺的部分物理性质如下表
| 乙酸 | 苯胺 | 乙酰苯胺 | |
| 沸点 | 118 | 184 | 304 |
| 状态 | 无色液体 | 无色液体 | 白色固体 |
| 在水中的溶解度 | 易溶于水 | 易溶于水20℃溶解度3.6g | 20℃溶解度0.46g;80℃溶解度3.5g;100C溶解度18g |
实验过程:①在50mL蒸馏瓶中加入沸石、乙酸7.4mL(过量),苯胺5mL,实验装置如下图所示(加热装置略去),先小火加热10分钟,再控制分馏柱温度为105℃,加热至反应完成。

②趁热将反应后的混合物倒入装有100mL冷水的烧杯中,快速搅拌,用布氏漏斗抽滤。
③洗涤沉淀、再抽滤得固体,检验乙酰苯胺中的乙酸是否被除尽。
④将沉淀转移到表面皿上,加热蒸发,除去水。
回答下列问题:
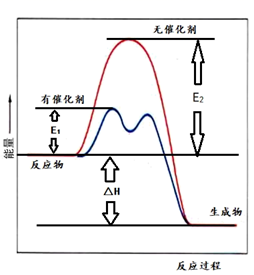
|
| 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.6 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
从表中数据分析,工业上采取400℃~500℃、1MPa条件下合成SO3的原因是。在T℃、1MPa条件下,SO2的平衡转化率为x,压强平衡常数Kp=(写出计算式即可)。(以分压代替物质的量浓度,分压=总压×物质的量分数)。
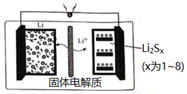
电池充电时,与电源负极所连电极发生的电极反应为,在电池放电时,电池右边电极依次发生Li2S8→Li2S6→Li2S4→Li2S2→Li2S系列转化。若放电前,图右边电极中Li2Sx只有Li2S8 , 放电后生成产物Li2S、Li2S2物质的量之比为6:1,则1mol Li2S8反应得到的电子数为。
|
名称(化学式) |
状态 |
熔点 |
溶解性 |
说明 |
|
四羰基镍 [Ni(CO)4] |
无色挥发性剧毒液体 |
-25℃ |
不溶于水,易溶于苯、四氯化碳等有机溶剂 |
正四面体分子、分子中碳原子与镍成健 |
|
氧化镍(NiO) |
绿色粉末状固体 |
1980℃ |
不溶于水 |
阴离子、阳离子构成 |
由此判断:[Ni(CO)4]是配合物,其配位体是。[Ni(CO)4]分子是分子(填“极性”或“非极性”)。[Ni(CO)4]比NiO熔点低的原因是。
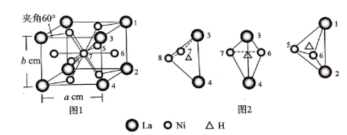
晶体中Ni、La的原子个数比=。每升该储氢材料达到储氢稳定状态,储氢原子mol。
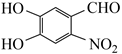 、CH3Cl、H2、Cu(OH)2、CH3OH等为主要原料可以合成另一种治疗肿瘤药物的中间体
、CH3Cl、H2、Cu(OH)2、CH3OH等为主要原料可以合成另一种治疗肿瘤药物的中间体  。补全合成过程(无机试剂任选)。
。补全合成过程(无机试剂任选)。