(I)SO2 + 2H2O
+ I2 → H2SO4 + 2HI,(II)2HI H2 + I2 , (III)2H2SO4 → 2SO2 + O2 + 2H2O
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
a.  b
b 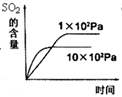
c.  d.
d. 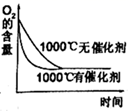
实际工业生产使用的条件是:常压、。