a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
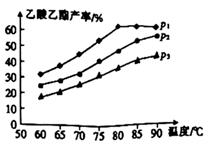
①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是[用 、
、
分别表示在不同压强下的反应速率]。
②在压强为 、温度超过80℃时,乙酸乙酯产率下降的原因可能是。
③为提高乙酸乙酯的合成速率和产率,可以采取的措施(任写两条)。