| 编号 | 实验目的 | 实验过程 |
| A | 配制0.4000mol.L-1的溶液 | 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
| B | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C | 制取并纯化氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
| 金属离子 | ||||
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。
②工艺中加入Na2CO3 , 固体,并再次充入SO2的目的是。
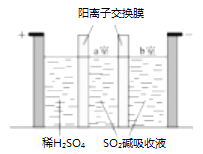
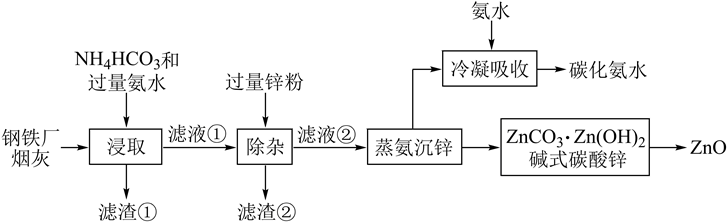
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
a.温度 b.Cl﹣的浓度 c.溶液的酸度
Ⅱ含铬元素溶液的分离和利用

阳极的电极反应式为,阴极产生的物质A的化学式为.
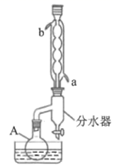
组装仪器,仪器A的名称是,冷凝水从口通入(填“a”或“b”)。
将仪器A中的溶液冷却至室温,倒入盛有30mL冷水的烧杯中,为除去硫酸和剩余的苯甲酸,可分批加入(填化学式)。
 已知:该实验条件下,Kw=1×10-14 , Ksp[Fe(OH)3]=1×10-38 , Ksp[Cr(OH)3]=1×10-32。回答下列问题:
已知:该实验条件下,Kw=1×10-14 , Ksp[Fe(OH)3]=1×10-38 , Ksp[Cr(OH)3]=1×10-32。回答下列问题:

相关金属离子[Co(Mn+ )=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Co2+ | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀的pH | 7.15 | 6.3 | 1.5 | 6.2 |
| 沉淀完全的pH | 9.15 | 8.3 | 2.8 | 8.2 |
回答下列问题:
A.KOH B.Zn(OH)2 C.ZnO D.Na2CO3

实验室用NH4Cl溶液和NaNO2溶液共热制备N2 , 装置A可选择(填标号)。

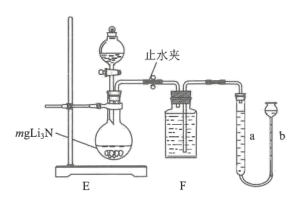
向圆底烧瓶中加水的操作是,。
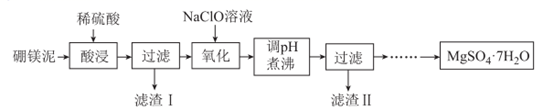
回答下列问题:

已知:还原焙烧的主反应为2MnO2+C 2MnO+CO2↑。
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
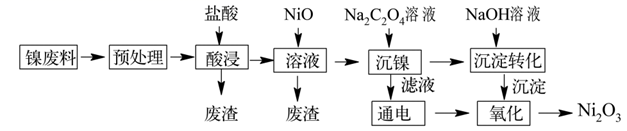
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
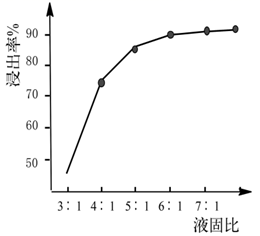
②常温下,盐酸的浓度为2.5mol·L-1 , “液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为,主要的原因是。


该样品中NaI的质量分数是。

据图推断操作II最好采用。反应①中若CO2通入过量造成的影响是。

|
装置I |
装置II |
||
|
烧瓶中 |
分液漏斗中 |
||
|
制备纯净Cl2 |
MnO2 |
浓盐酸 |
|
|
制备纯净NO |
Cu |
稀硝酸 |
水 |
①装置连接顺序为a→(按气流自左向右方向,用小写字母表示)。
②装置IV、V除可进一步干燥NO、Cl2外,另一个作用是。

①样品的纯度为%(保留三位有效数字)
②若在滴定终点时测得溶液中CrO 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是。
 回答下列问题:
回答下列问题:

已知:①Ca(H2PO4)2能溶于水,CaHPO4和Ca3(PO4)2均难溶于水。
②萃取原理:KCl+H3PO4⇌KH2PO4+HCl,HCl易溶于有机萃取剂。
回答下列问题:
A.氧化性 b.还原性 c.强酸性

①b物质为。
②阳极反应式为。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:


已知:①铅膏的组成如表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 质量分数/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:

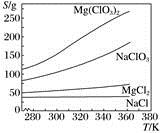
①由图甲确定适宜的配比为。
②已知70 ℃时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是,工业上采用质量分数约为24%的食盐水,不能采用无限制提高w(NaCl)来提高铅的浸出率,其原因是。
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有(至少写2种)。
①硫酸铅溶于氯化钠生成PbCl 的离子方程式为。
②产生氯气的化学方程式为。

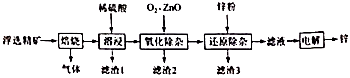
已知:①“焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2。
②"氨浸"时,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4。
③[Cu(NH3)4](OH)2 [Cu(NH3)4]2++2OH-。
回答下列问题:
①为了使辉钼矿充分培烧,需要采取的措施是 (写出一种)。
②马弗炉中逸出的气体可用溶液吸收。
③MoS2转化成MoO3的化学方程式为。

I.实验操作:
①向装置A的三颈烧瓶中加入乙醇20 g、亚硝酸钠40 g、水60 g后,混合均匀;
②将装置A的三颈烧瓶中的混合液体加热到35 ℃左右,控制滴入70%硫酸的速率;
③在装置B的三颈烧瓶中预装由水合肼(N2H4• H2O、NaOH溶液、乙醇和催化剂组成的混合液,打开活塞K,使装置A中产生的亚硝酸乙酯(C2H5ONO)进入装置B中,控制温度在70-90 ℃内,持续加热40 mino
II.部分药品的性质如下表:
| 密度/g • cm-3 | 熔点/°c | 沸点/°c | 溶解性 | |
| 乙醇 | 0.816 | -114 | 7& 4 | 与水以任意比例互溶,可与醚、氯仿、丙酮混溶 |
| 亚硝酸乙酯 | 0. 90 | -93 | 17.2 | 不溶于水,可溶于乙醇、乙醚 |
| 叠氮化钠 | 1. 85 | 275 | 300 | 易溶于水和液氨,微溶于乙醇,不溶于乙醚 |
已知:2C2 H5OH+H2SO4+2NaNO2 2C2 H5ONO↑ +Na2SO4+2H2Oo
回答下列问题:

①到达滴定终点时的现象为。
②叠氮化钠的纯度为。
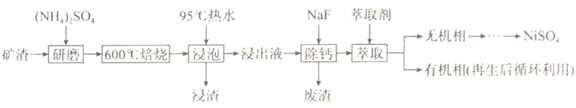

铝制易拉罐经稀硫酸微热溶解,加入H2O2溶液,调节pH=3.7,第一次过滤后向滤液中加入少量NaHCO3饱和溶液,第二次过滤出白色沉淀。趁热加入质量分数为a% H2SO4溶液和K2SO4固体,然后冷却、洗涤、第三次过滤,得到粗明矾。
完成实验报告:
①为了加快溶解,铝制易拉罐首先要;
②配制a% H2SO4溶液的仪器:烧杯、玻璃棒、(从图中选择,写出名称)。

①加入H2O2氧化Fe2+时,H2O2实际消耗量常超出氧化还原计算的用量,你预计可能的原因是;
②思考:在本实验中,含铁杂质在第次过滤中被去除。
①现象记录:“向滤液中加入少量NaHCO3饱和溶液”处理,溶液中产生。
②思考:(填“有”或“无”)必要用KHCO3替代NaHCO3。
①加入a%H2SO4溶液时,a最好是(选填“20%”、“60%”或“98%”)。
②为了提高明矾收率,可采取、措施。
为减少试剂用量、方便除杂,设计制备明矾的新方案如下:
易拉罐经溶液微热溶解,过滤后向滤液中加入溶液,第二次过滤出白色沉淀。加入H2SO4溶液和K2SO4固体,然后冷却、洗涤、过滤,得到粗明矾。
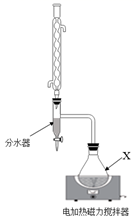
I.向100mL反应容器X中,加18.5g正丁醇,16.8g 冰醋酸,1gKHSO4 , 混匀,加2粒沸石。接上冷凝管和分水器。
II.加热反应开始后,控制回流速度1~ 2滴/s,大约40 min后,反应完成,停止加热。
III.分离提纯产品。过滤回收KHSO4 , 将滤液和分水器分出的酯层一起倒入分液漏斗中,用10 mL水洗涤; ……蒸馏得到产品29.0 mL。
已知:
| 名称 | 相对分子质量 | 溶解性 | 密度(g/cm3) | 沸点(℃) |
| 正丁醇 | 74 | 稍溶于水和易溶于有机溶剂 | 0.81 | 117.7 |
| 冰醋酸 | 60 | 能溶于水和有机溶剂 | 1.05 | 117.9 |
| 乙酸正丁酯 | 116 | 难溶于水 | 0.90. | 126.5 . |
回答下列问题:
a.再用10mL水洗涤; b.用无水硫酸镁干燥;
c.用10 mL 10%Na2CO3洗涤; d.过滤


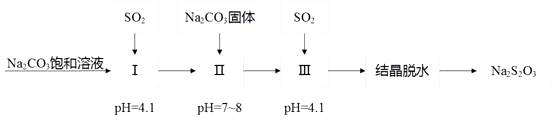
已知:在pH为4~6时Fe3+水解生成Fe(OH)3•2nFe3+•3(n-x)SO 胶体,具有吸附性。

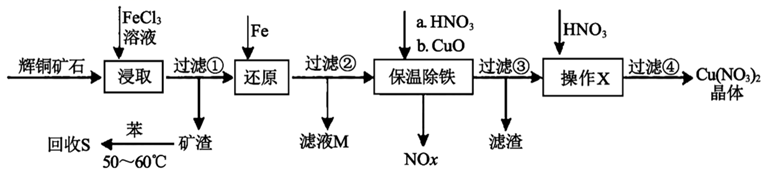
①回收S,温度控制在50℃~60℃之间,温度不宜过高或过低的原因分别是、。
②气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为;向滤液M中加入(或通入)下列 (填正确答案标号)物质,可得到另一种可循环利用的物质。
A.铁 B.氯气 C.高锰酸钾 D.盐酸
③保温除铁过程中加入CuO的作用是。
④操作X中硝酸溶液的作用是。
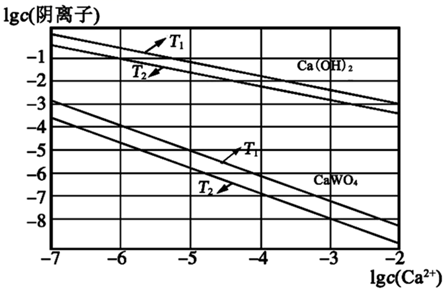
①T1T2(填“>”或“<”);T1时,Ksp(CaWO4)=。
②向钨酸钠溶液中加入石灰乳得到大量钨酸钙,发生反应的离子方程式为。
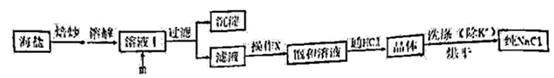
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳

①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是(填编号),相比分液漏斗,选用仪器a的优点是。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是。
| 操作 | 目的/结论 | |
| ① | 称取样品 | 目的:。 |
| ② | 过滤洗涤,干燥后称得沉淀为m2g | 结论:样品中SO |
Fe2(SO4)3溶液 FeSO4溶液
(NH4)2Fe(SO4)2溶液
莫尔盐
已知:硫酸铵、水合硫酸亚铁、硫酸亚铁铵在水中的溶解度
| 10 | 20 | 30 | 40 | |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 |
| FeSO4∙7H2O | 40.0 | 48.0 | 60.0 | 73.3 |
| (NH4)2SO4∙ ∙FeSO4∙6H2O | 18.1 | 21.2 | 24.5 | 27.9 |
完成下列填空:

①蒸馏水要预先加热煮沸的原因是;配成250mL溶液的定量仪器为。
②若滴定前不用标准液润洗滴定管,将会导致最终结果(选填“偏大”、“偏小”或“不变”);
③已知滴定反应中n(Fe2+):n( )为5:1,该样品的纯度为。

a.萃取 b.升华 c.纸层析 d.过滤
a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
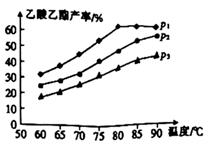
①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是[用 、
、
分别表示在不同压强下的反应速率]。
②在压强为 、温度超过80℃时,乙酸乙酯产率下降的原因可能是。
③为提高乙酸乙酯的合成速率和产率,可以采取的措施(任写两条)。

“系列操作”依次为:恒温80℃加热蒸发→→→→→→三草酸合铁酸钾晶体粗产品。(填字母)
a.过滤
b.避光晾干
c.冰水浴冷却热饱和溶液
d.用95%的乙醇溶液洗涤晶体
e.加热至溶液表面出现亮绿色晶体,停止加热
配制100mL 0.1000
溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、量筒、锥形瓶外还有(填仪器名称),加入锌粉的目的是。
_ _
_
![]() →_
→_ _
_
![]()
第二次滴定终点的现象。
取草酸铁钾溶液按如图所示装置进行实验,观察到A中产生浅黄色沉淀和无色气体,B中变浑浊,推测浅黄色沉淀中铁元素的化合价为。
