已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)DH1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g)=2NO(g)DH2=+180.5kJ·mol-1
回答下列问题:
①DH=kJ·mol-1。
②恒温恒压时,下列能说明该反应已达到化学平衡状态的是(填标号)。
A.v逆(NO)=2v正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再改变
D.混合气体的平均相对分子质量不再变化

①催化剂为FeNb0.4Ox时,试分析温度大于350℃时,NO转化率降低的原因是。
②研究表明该反应v=kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。若初始速率为r,当H2转化率为50%时,反应速率为 r,由此可知m=。设该反应的活化能为Ea , 不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在下列关系:lg
=
(
﹣
)(R为常数)。据此推测升高温度时,活化能大小与速率常数变化情况的关系:。
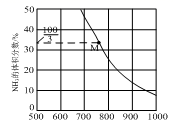
若q=10时,M点的N2的分压=MPa。此时该反应的压强平衡常数Kp=(MPa)-2(保留三位有效数字)(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。