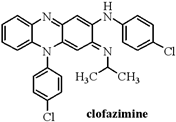
下列有关clofazimin的叙述正确的是( )


| ① | ② | ③ |
| | | |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法错误的是( )
![]()
部分物质相关性质如下表:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
| 间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
| 2-硝基-1, 3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取77.0 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15 min(如图1)。
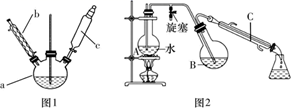
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。
请回答下列问题:
A.30~60℃ B.60~65℃
C.65~70℃ D.70~100℃

已知:①稀土离子易和SO 形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O= Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为 ![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)DH1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g)=2NO(g)DH2=+180.5kJ·mol-1
回答下列问题:
①DH=kJ·mol-1。
②恒温恒压时,下列能说明该反应已达到化学平衡状态的是(填标号)。
A.v逆(NO)=2v正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再改变
D.混合气体的平均相对分子质量不再变化

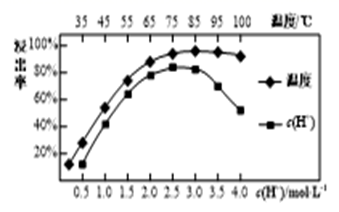
①催化剂为FeNb0.4Ox时,试分析温度大于350℃时,NO转化率降低的原因是。
②研究表明该反应v=kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。若初始速率为r,当H2转化率为50%时,反应速率为 r,由此可知m=。设该反应的活化能为Ea , 不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在下列关系:lg
=
(
﹣
)(R为常数)。据此推测升高温度时,活化能大小与速率常数变化情况的关系:。
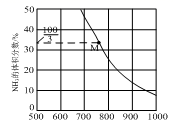
若q=10时,M点的N2的分压=MPa。此时该反应的压强平衡常数Kp=(MPa)-2(保留三位有效数字)(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
|
卤化物 |
CrCl3 |
CrBr3 |
CrI3 |
|
熔点/℃ |
1150 |
600 |
试预测CrBr3的熔点范围。
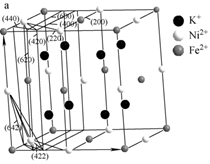
a.反应①需用铁粉作催化剂
b.曲美布汀的含氧官能团为酯基和醚键
c.E中所有碳原子可处于同一平面
d.化合物G能发生取代反应、加成反应和消去反应
i.M为苯的二元取代物
ii.既能发生银镜反应又能发生水解反应