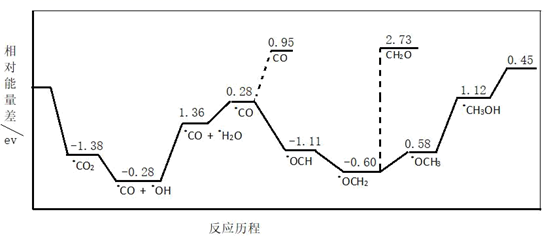
容易得到的副产物有CO和CH2O,其中相对较少的副产物为;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中(填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•OCH
C.•OCH2 •OCH3 D.•CO + •OH
•CO + •H2O
在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2 , 在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。
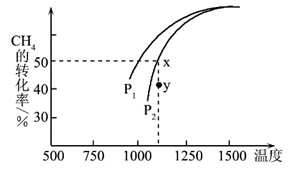
y点:v(CO)正v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=Pa2。

电池工作过程中,阴极的电极反应式为。