
 B .
B .  C .
C .  D .
D . 
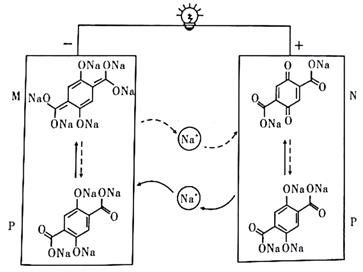

 +H2O
C . 制得
+H2O
C . 制得 
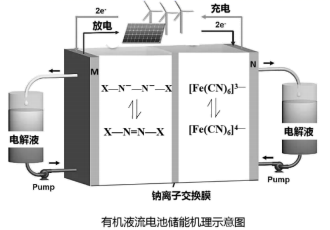
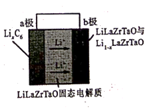
(电池总反应为: LixC6+LisxLaZrTaO LiLaZrTaO+6C)

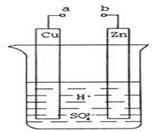
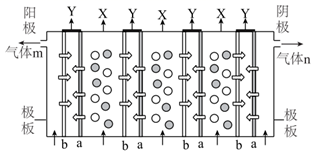
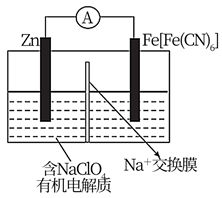
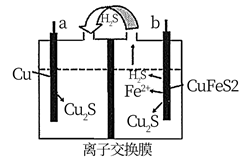
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。

| 实验装置 | 实验编号及试剂 | 实验现象 |
| | ① | 阳极:产生有刺激性气味的气体 阴极:电极上有红色固体析出 |
| ② | 阳极:产生有刺激性气味的气体 阴极:电极上有少量红色固体和白色固体析出,同时电极附近液体变为黑色 |
查阅资料:
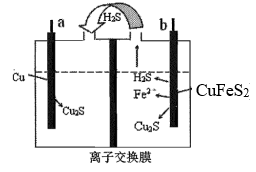
i.阴极附近的白色固体为 ;
ii. 在水溶液中单独存在时不稳定,容易发生反应:
。
结合资料分析CuCl产生的路径有如下两种可能:
路径1:阴极发生电极反应分两步:
i.
ⅱ. ,同时伴随反应
,生成白色沉淀。
进一步查阅资料,提出以下猜想。
猜想1.生成氢氧化铜,进而转化为极细小的氧化铜;
猜想2.生成铜的速率快,形成黑色纳米铜;
猜想3.发生反应 (棕黑色)。
若猜想1成立,则阴极一定还存在的电极反应是。
取2mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
| 实验编号 | ③ | ④ | ⑤ |
| 加入试剂 | 4mL浓 | 4mL浓HCl | |
| 实验现象 | 溶液变澄清,呈绿色,试管口有浅红棕色气体生成 | 黑色液体颜色变深 | 溶液变澄清,呈绿色,同时出现少量白色沉淀 |
甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。药品说明书中“与Vc同服可增加本品吸收”,通过探究,说明Vc具有性。
①该实验中的试剂2与甲同学设计的实验中的试剂1都可以是(填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
②请计算该药品含“铁”的质量分数为(保留三位有效数字)。
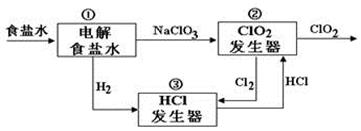
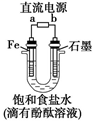
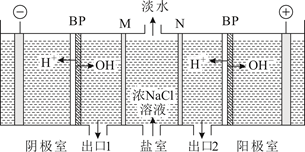
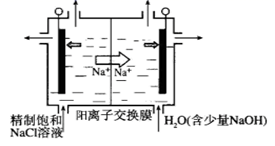
下图为用石墨做电极,在一定条件下电解饱和食盐水制取ClO2的装置。写出阳极产生ClO2的电极反应式: 。电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为mol。
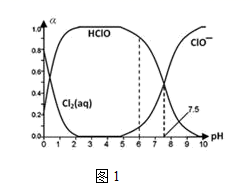
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为。

①从能量角度看,C、D、E中最不稳定的离子是(填离子符号)。
②B→A+D反应的热化学方程式为(用离子符号表示)。
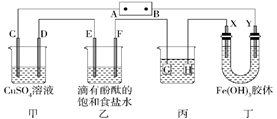
若AB电源是甲醇在酸性环境的燃料电池,则甲中C极的电极反应式为。
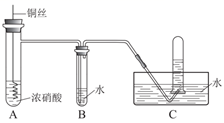
浓硝酸一般盛放在棕色试剂瓶中,原因是。
①该反应的化学平衡常数表达式为K=。
②若在一定温度下,将2molNO,1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示。则前20min内用CO2的浓度变化表示的反应平均速率为。
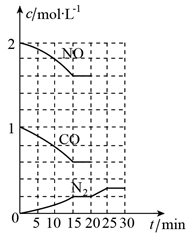
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是(填序号)。
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加 的量
i. CO2(g)+ H2(g) CO(g)+H2O(g) ΔH1=+41 kJ·mol-1 ,
ii. 2CO2(g)+6 H2(g) CH3OCH3(g)+3H2O(g) ΔH2=-121 kJ·mol-1 ,
iii. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH3=-23kJ·mol-1 ,
回答下列问题:
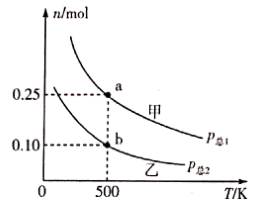
①500K下,反应达到平衡时甲、乙两个容器的容积之比为。
②测得p总1=0.2MPa,则500K时反应的平衡常数Kp=MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③500K时经过20min乙容器内反应达到b点的平衡状态,则0~20min内的平均反应速率v(H2)=mol·min-1。
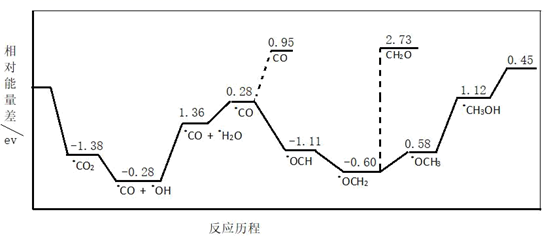
容易得到的副产物有CO和CH2O,其中相对较少的副产物为;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中(填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•OCH
C.•OCH2 •OCH3 D.•CO + •OH
•CO + •H2O
在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2 , 在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。
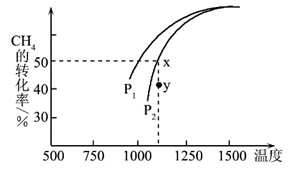
y点:v(CO)正v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=Pa2。

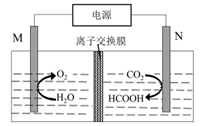
电池工作过程中,阴极的电极反应式为。

主要热化学反应如下:
I.2Ni(s)+O2(g)=2NiO(s) ∆H=-479.8kJ∙mol-1
II.CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ∆H=+68.9kJ∙mol-1
①CH4的燃烧热是。
②与直接燃烧CH4相比“化学链燃烧”的优点为。
a.燃烧等质量的CH4 , 放出的热量多
b.有利用于二氧化碳的分离与回收
c.燃烧等质量的CH4 , 消耗的O2少
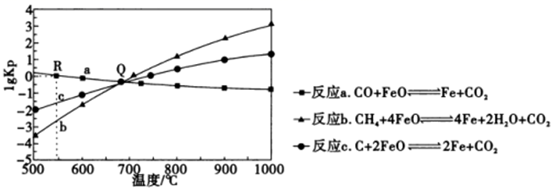
①R点对应温度下向某恒容密闭容器中通入1.0molCO和0.2molCO2 , 并加入足量的FeO,只发生反应a:CO(g)+FeO(s)=CO2(g)+Fe(s),则CO的平衡转化率为。
②若某恒容密闭容器中只发生反应b和c,平衡时对应上图中Q处时,容器中气体分压p(X)间应满足的关系是。
①T℃下该反应的Kp=。
②其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率(填“增大”“减小”或“不变”)。
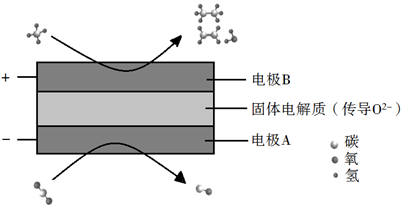
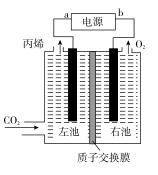
①写出生成乙烯的电极反应式为:。
②若生成的乙烯和乙烷的体积比为1:2,则消耗的CH4和CO2体积比为。