已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=。
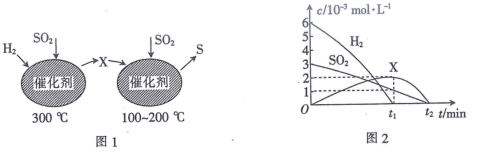
①由分析可知X为 (填化学式)。
②0~t1时间段的温度为。
①0~5min内,CO的反应速率是;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH(填“>”或“<”)0。
②T℃时,平衡常数Kp=Pa-1。
①钠硫电池是一种新型高能电池,总反应为2Na+2S Na2S2 , 该电池工作时正极的电极反应式为;给该电池充电时,钠电极应与外电源的(填“正”或“负”)极相连接。
②在碱性溶液中,S 被BrO
氧化成SO
,BrO
被还原成Br-。该反应的离子方程式是。