| 选项 | 实验操作和现象 | 结论 |
| A | 将NH3通过灼热的CuO粉末,有红色固体生成 | NH3具有还原性 |
| B | 将某溶液滴在KI淀粉试纸上,试纸变蓝 | 原溶液中可能存在I2 |
| C | 向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液,溶液变红 | 氧化性:Fe3+<Ag+ |
| D | 向盛有2mL一定浓度的Na3[Ag(S2O3)2]溶液的试管中,滴入5滴2mol·L-1的KI溶液,产生黄色沉淀 | [Ag(S2O3)2]3-发生了电离 |

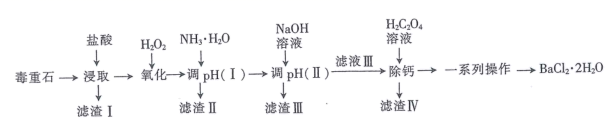
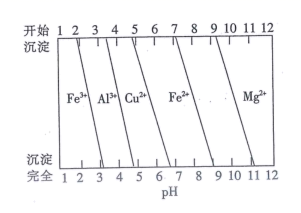
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
|
改变的条件 |
温度(℃) |
盐酸的浓度(%) |
液固比 |
||||||||||
|
30 |
55 |
75 |
10 |
15 |
20 |
25。 |
3:1 |
4:1 |
5:1 |
6:1 |
|||
|
钡的浸出率(%) |
74.31 |
69.60 |
68.42 |
59.21 |
74.31 |
74.15 |
55.32 |
59.84 |
65.12 |
74.31 |
74.35 |
||
分析表中数据,温度越高钡的浸出率越低的可能原因是;判断“浸取”的最佳液固比为。
①滴定至终点时的现象为。
②该溶液中钙离子的浓度为 (用含 V1、V2的代数式表示)g·mL-1。
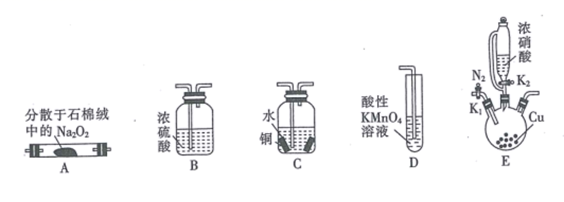
已知:①2NO+Na2O2 =2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO ;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3 +2NO↑+ H2O。
回答下列问题:
已知:①2NO +4H++2I- =2NO↑ +I2 +2H2O
②I2+2Na2S2O3=2NaI+Na2S4O6
已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=。
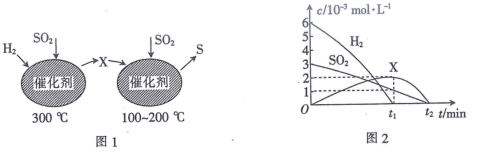
①由分析可知X为 (填化学式)。
②0~t1时间段的温度为。
①0~5min内,CO的反应速率是;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH(填“>”或“<”)0。
②T℃时,平衡常数Kp=Pa-1。
①钠硫电池是一种新型高能电池,总反应为2Na+2S Na2S2 , 该电池工作时正极的电极反应式为;给该电池充电时,钠电极应与外电源的(填“正”或“负”)极相连接。
②在碱性溶液中,S 被BrO
氧化成SO
,BrO
被还原成Br-。该反应的离子方程式是。
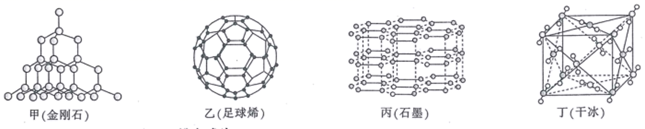
|
与F的相对位置 |
邻 |
间 |
对 |
其他 |
|
含量/% |
38.8 |
3.66 |
57.25 |
0.29 |
请找出规律:
I.苯环上只有三个取代基且处于邻位,且-SH、-F直接与苯环相连;
II.能发生银镜反应;
III.能与NaHCO3溶液反应。