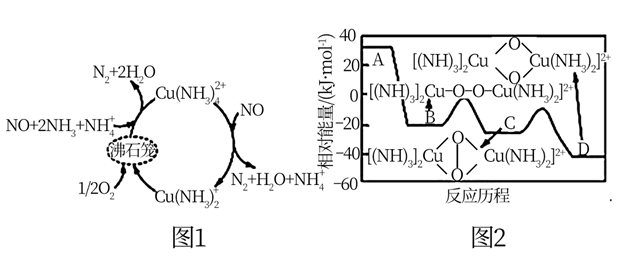
①由A到B的变化过程可表示为。
②已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-907.28kJ·mol-1
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H2=-1269.02kJ·mol-1
则图1脱除NO的总反应的热化学方程式为。
③关于该催化剂的说法正确的是(填标号)。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
Ⅰ.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)△H1
Ⅱ.2NO(g)+Cl2(g) 2ClNO(g)△H2
①关于恒温恒容密闭容器中进行的反应Ⅰ和Ⅱ的下列说法中,正确的是(填标号)。
a.△H1和△H2不再变化,说明反应达到平衡状态
b.反应体系中混合气体的颜色保持不变,说明反应Ⅰ达到平衡状态
c.同等条件下,反应Ⅰ的速率远远大于反应Ⅱ,说明反应Ⅰ的活化能小,△H1<△H2
d.达平衡后,向反应体系中再通入一定量ClNO(g),NO2(g)和NO(g)的百分含量均减小
②若向2L恒容密闭容器中加入0.2molNO和0.1molCl2发生反应Ⅱ,起始总压为p。10分钟后达到平衡,用ClNO(g)表示平均反应速率v平(ClNO)=0.008mol·L-1·min-1。则NO的平衡转化率α=,该反应的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③假设反应Ⅱ的速率方程为:v=k (1-nαt)式中:k为反应速率常数,随温度t升高而增大;α为NO平衡转化率,α′为某时刻NO转化率,n为常数。在α′=0.8时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线如图所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm , t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。