
下列说法错误的是( )




已知:无水氟硅酸(H2SiF6)为易溶于水、不稳定的强酸;滤渣2的主要成分为Na2SiF6。
下列说法错误的是( )

| 选项 | 实验操作和现象 | 结论 |
| A | 向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液,溶液变红 | 氧化性:Fe3+<Ag+ |
| B | 将蘸有浓氨水的玻璃棒靠近溶液X,有白烟产生 | 溶液X一定是浓盐酸 |
| C | 将电石与水反应产生的气体通入溴水,溴水褪色 | 生成的乙炔气体中含有H2S |
| D | 向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |




 +2NO
B . CH3ONO中氮氧双键在Pd表面断裂
C . 增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D . 脱附过程2生成了碳酸二甲酯(
+2NO
B . CH3ONO中氮氧双键在Pd表面断裂
C . 增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D . 脱附过程2生成了碳酸二甲酯(  )
)


已知:
①Ag、Cu、Fe的氧化物不溶于Na2S溶液
②硫浸后,锑砷以Na3SbS3、Na3AsS3存在;
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
|
物质 |
H3AsO3 |
Fe2+ |
|
浓度/g·L-1 |
0.378 |
0.840 |
已知:Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21 , H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用方法除去该废水中的砷,除去砷后的废液中c(AsO )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
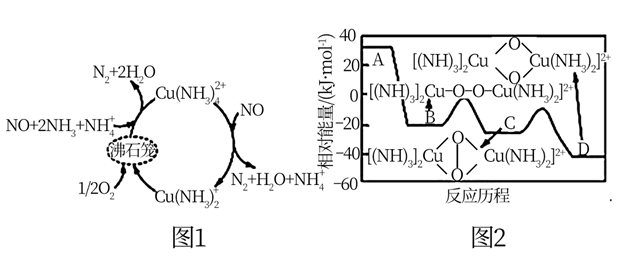
①由A到B的变化过程可表示为。
②已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-907.28kJ·mol-1
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H2=-1269.02kJ·mol-1
则图1脱除NO的总反应的热化学方程式为。
③关于该催化剂的说法正确的是(填标号)。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
Ⅰ.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)△H1
Ⅱ.2NO(g)+Cl2(g) 2ClNO(g)△H2
①关于恒温恒容密闭容器中进行的反应Ⅰ和Ⅱ的下列说法中,正确的是(填标号)。
a.△H1和△H2不再变化,说明反应达到平衡状态
b.反应体系中混合气体的颜色保持不变,说明反应Ⅰ达到平衡状态
c.同等条件下,反应Ⅰ的速率远远大于反应Ⅱ,说明反应Ⅰ的活化能小,△H1<△H2
d.达平衡后,向反应体系中再通入一定量ClNO(g),NO2(g)和NO(g)的百分含量均减小
②若向2L恒容密闭容器中加入0.2molNO和0.1molCl2发生反应Ⅱ,起始总压为p。10分钟后达到平衡,用ClNO(g)表示平均反应速率v平(ClNO)=0.008mol·L-1·min-1。则NO的平衡转化率α=,该反应的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③假设反应Ⅱ的速率方程为:v=k (1-nαt)式中:k为反应速率常数,随温度t升高而增大;α为NO平衡转化率,α′为某时刻NO转化率,n为常数。在α′=0.8时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线如图所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm , t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。
①氨硼烷能溶于水,其原因是。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是。
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
③氨硼烷电池放电时的总反应为:H3NBH3+3H2O2=NH4BO2+4H2O。写出负极电极反应。


①该晶体中Na+的配位数为。标注为“1”的Na+分数坐标为。
②H3BO3分子中的O—B—O的键角(填“大于”、“等于”或“小于”)BH 中的H—B—H的键角。
③已知硼氢化钠晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值,则a=(用含ρ、NA的代数式表示);
④若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为。

已知:
① ![]() +
+ ![]()
 (其中一种产物)
(其中一种产物)
② ![]() +
+ ![]()
![]() +R2OH
+R2OH
③烯醇式( ![]() )结构不稳定,容易结构互变,但当有共轭体系(苯环、碳碳双键、碳氧双键等)与其相连时变得较为稳定。
)结构不稳定,容易结构互变,但当有共轭体系(苯环、碳碳双键、碳氧双键等)与其相连时变得较为稳定。
①属于芳香族化合物,但不含甲基;
②与FeCl3溶液发生显色反应;
③1mol该有机物能与2molNaOH恰好完全反应;
④核磁共振氢谱有4组峰,且峰面积之比为2:2:1:1。

已知:实验原理为2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O
①该样品的有效氯测定值%。(用含a,V的代数式表示)
②下列操作会导致样品的有效氯测定值偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前无气泡,滴定后有气泡
c.碘量瓶中加入的稀硫酸偏少
已知:①该样品的有效氯= ×100%
②实验检测原理为:C3N3O3Cl +2H2O=C3H3N3O3+2HClO
HClO+2I-+H+=I2+Cl-+H2O 测定中转化HCl的氯元素质量
I2+S2O =S4O
+2I-