i. CO2(g)+ H2(g) CO(g)+H2O(g) ΔH1=+41 kJ·mol-1 ,
ii. 2CO2(g)+6 H2(g) CH3OCH3(g)+3H2O(g) ΔH2=-121 kJ·mol-1 ,
iii. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH3=-23kJ·mol-1 ,
回答下列问题:
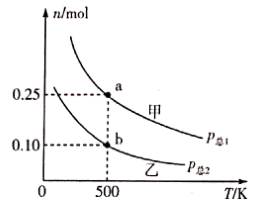
①500K下,反应达到平衡时甲、乙两个容器的容积之比为。
②测得p总1=0.2MPa,则500K时反应的平衡常数Kp=MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③500K时经过20min乙容器内反应达到b点的平衡状态,则0~20min内的平均反应速率v(H2)=mol·min-1。