|
汞(有毒) |
氧化汞 |
| ||
| 密度 | 13.546g/cm3 | 密度 | 11.14g/cm3 | |
| 沸点 | 356.58℃ | 不能溶于汞 | ||
| 加热至沸与氧气反应,12天 | 分解温度 | 500℃ | ||
① 写出汞与氧气反应的化学方程式。
②拉瓦锡在实验中选择使用“汞”的优点如下:
A 液态的汞在汞槽中既起到液封的作用,又能直接用来测见反应器内空间体积的变化。
B 汞加热后只跟氧气反应,且生成的氧化汞易加热分解又得到原先质量的汞和氧气,把得到的氧气加到剩下的4/5体积的气体中,结果所得气体跟空气的性质完全相同
C 氧化汞的密度小于汞,且不溶于汞,因此易与汞分离。
D 汞的沸点低,汞蒸气与氧气反应比较充分,能将密闭装置内空气中的氧气几乎耗尽。
但现在实验室的模仿研究却不用“汞”的原因有:。
③加热红色氧化汞粉末得到汞和氧气的微观过程如下:
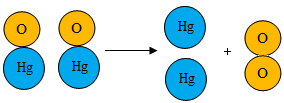
根据图示获得的信息是。
A 可说明分子质量大,原子质量小
B 可说明原子也能保持物质的化学性质
C 氧化汞由一个汞原子和一个氧原子构成
D 所得氧气与原空气中的氧气化学性质相同
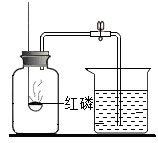
用燃烧磷的方法测出的氧气含量常常远低于21%。
(提出问题)用红磷燃烧的方法测出的氧气含量为什么常常远远偏低?
(进行猜想)可能的原因有①装置漏气;②,装置内氧气有剩余;等……。
(交流与反思)查阅资料得知白磷剧毒、磷燃烧产生的白烟接触水后也有毒。与用红磷、白磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点是,缺点是。
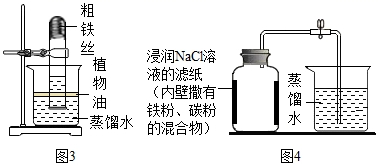
|
实验前的体积/mL |
实验后的体积/mL |
|
|
集气瓶内空气 |
烧杯内蒸馏水 |
烧杯内剩余蒸馏水 |
|
130 |
90.0 |
63.7 |
请列式计算出空气中氧气含量为(计算结果保留一位小数)