 B . 粉碎矿石
B . 粉碎矿石  C . 淘洗矿粉
C . 淘洗矿粉  D . 取泥制坯
D . 取泥制坯 
| | | | |
| A | B | C | D |
| | | | |
| A 长劲漏斗 | B 量桶 | C 镊子 | D 椎形瓶 |
| | | | |
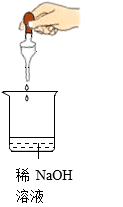
| A 溶解氯化钠 | B 熄灭酒精灯 | C 放铁钉入试管内 | D 取少量硫酸溶液 |
 B . 放置滴管
B . 放置滴管 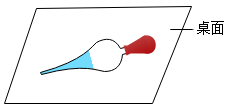 C . 取用盐酸
C . 取用盐酸  D . 搅拌溶液
D . 搅拌溶液 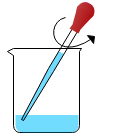

| | | | |
| 氧分子O2 | 氢分子H2 | 氨分子NH3 | 二氧化碳分子CO2 |
| | | | |
| A | B | C | D |
①常代替氢气充气球的气体;
②医用体温计里的物质通常是;
③天然气的主要成分是;
④作食品干燥剂的生石灰;
⑤区别石灰水和蒸馏水的气体是,其反应的化学方程式。
|
化学符号 |
锌 |
2个钾原子 |
n个氯分子 |
四个氢氧根 |
|
五个水分子 |
氧化镁中+2价的镁元素 |
|||
|
胃部光透视的病人需口服含BaSO4造影剂,BaSO4中所含金属元素的名称是 |
||||
|
地壳含量最多的金属元素和人体含量最多的非金属元素组成化合物的化学式是 |
||||
① 向空气中大量排放SO2会导致的产生;含有金属元素的粉尘会加速SO2转化,此时粉尘可能起到的是作用。
② 过多CO2的排放会加剧 。
③为了减缓大气中CO2含量的增加,目前以下建议中可行的是。
A 开发太阳能、风能、地热能等新能源
B 禁止使用煤、石油、天然气等化石燃料
C 电解水制取最清洁的能源一一氢气
D 开发燃煤新技术,使煤炭充分燃烧

①医用防护中“N95”型口罩对微小带病毒气溶胶或有害微尘的阻隔效果显著。下列操作与口罩阻隔原理相似的是(填字母)。
A 溶解 B 过滤 C 蒸发
②75%的区用酒精和84消毒液能有效消灭病毒,酒精(C2H5OH)属于易燃物,使用酒精消毒应远离火源。酒精的式量为;其中的元素含量最小;
③84消毒液属于含氯消毒剂,这里的氯是指(填“元素”“原子”或“分子”);84消毒液中的有效成分为次氯酸钠NaClO,次氯酸钠中氯元素的化合价为。
Ⅰ 现有:①水②液氧③铜④氧化铁⑤洁净的空气等五种物质。
其中属于混合物的是(填序号);属于单质的是(填化学式);属于氧化物的是(填化学式);
Ⅱ 根据微观示意图,用编号填空:
|
| | | |
| 甲 | 乙 | 丙 | 丁 |
其中属于混合物的是;属于纯净物的是;属于单质的是;可能属于氧化物的是;
Ⅲ 如果用“ ![]() ”表示氢原子,用“
”表示氢原子,用“ ![]() ”表示氯原子。下图是氢气在氯气中燃烧生成氯化氢气体的微观过程示意图。试根据氢气在氯气中燃烧的微观过程示意图填空。
”表示氯原子。下图是氢气在氯气中燃烧生成氯化氢气体的微观过程示意图。试根据氢气在氯气中燃烧的微观过程示意图填空。
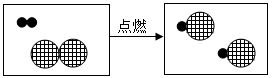
① 该反应的化学方程式为;基本反应类型。
② 氯气是一种黄绿色、有刺激性气味的有毒气体。无论是氯气(气态Cl2)还是液氯(液态Cl2),均有毒性。从微观的角度解释其原因是;。
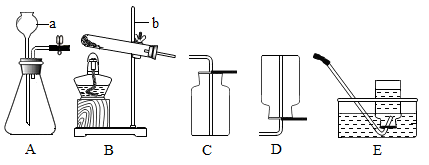
Ⅰ.写出仪器a和b的名称是、。
Ⅱ.检查装置A气密性的方法是夹紧止水夹,,则气密性良好。
Ⅲ.加热氯酸钾和二氧化锰混合物的化学方程式为。
①.若需制取较纯的氧气,选择的装置组合为(填字母),仪器选择的依据是(填字母);
A属于固固加热型的反应 B 属于固液加热型的反应
C 制取的气体密度比空气大 D 制取的气体不易溶于水
②上述混合物中的氯酸钾是色固体;反应后的固体中二氧化锰的质量分数将(填“增大”、“减少”、“不变”);充分反应后需要从剩余固体中提取二氧化锰的操作是溶解、、洗涤、干燥。
Ⅳ 用双氧水和二氧化锰制氧气的的化学方程式为,判断用C装置收集满氧气的方法是。
Ⅴ 实验室常用加热无水醋酸钠和碱石灰二种固体混合物的方法制备甲烷。
①根据上图选择的发生装置为(填字母);
② 实验中可以用装置E收集甲烷,说明甲烷具有的物理性质;
③ 实验中还可以用装置D而不用装置C收集甲烷,由此反映了甲烷的密度比空气(填“大”或“小”)。
Ⅰ 过滤:是分离和液体的方法。
如图是过滤装置的一部分,请根据图回答:
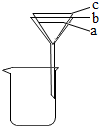
①若滤纸的边缘有图中的三个位置,则最恰当的位置是(填“a”、“b”或“c”)。
②倒入的液体的液面应略低于(填“a”、“b”域“c”)。
③在过滤的操作过程中,下列可行的操作是。
A 赶走滤纸与漏斗内壁间的气泡 B 将漏斗下端管口悬在烧杯中央
C 过滤时用玻璃棒在漏斗中搅拌 D 可将待过滤的液体先静置片刻再进行过滤操作
Ⅱ 粗盐中含有较多的杂质,按照课本“活动与探究”的要求做粗盐提纯实验并计算产率。
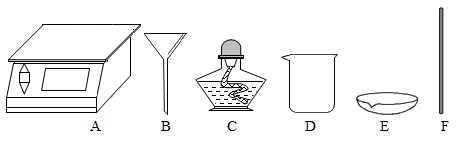
① 仪器E的名称是;在实验中用得最多的仪器是(填名称)。要完成该实验还缺少的仪器是。
② 蒸发时防止液滴飞溅的操作是。
③ “活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发、⑤称量,正确的操作顺序为(填序号)。
④如果学生在操作中发现过滤后的溶液依然浑浊,可能的原因之一是。
| ⑤如果学生通过正确计算,实验测得的结果比实际偏低,分析可能的原因之一是: | |
| 溶解过程 | 。 |
| 蒸发过程 | 。 |
| 称量过程 | 。 |
|
汞(有毒) |
氧化汞 |
| ||
| 密度 | 13.546g/cm3 | 密度 | 11.14g/cm3 | |
| 沸点 | 356.58℃ | 不能溶于汞 | ||
| 加热至沸与氧气反应,12天 | 分解温度 | 500℃ | ||
① 写出汞与氧气反应的化学方程式。
②拉瓦锡在实验中选择使用“汞”的优点如下:
A 液态的汞在汞槽中既起到液封的作用,又能直接用来测见反应器内空间体积的变化。
B 汞加热后只跟氧气反应,且生成的氧化汞易加热分解又得到原先质量的汞和氧气,把得到的氧气加到剩下的4/5体积的气体中,结果所得气体跟空气的性质完全相同
C 氧化汞的密度小于汞,且不溶于汞,因此易与汞分离。
D 汞的沸点低,汞蒸气与氧气反应比较充分,能将密闭装置内空气中的氧气几乎耗尽。
但现在实验室的模仿研究却不用“汞”的原因有:。
③加热红色氧化汞粉末得到汞和氧气的微观过程如下:
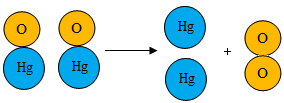
根据图示获得的信息是。
A 可说明分子质量大,原子质量小
B 可说明原子也能保持物质的化学性质
C 氧化汞由一个汞原子和一个氧原子构成
D 所得氧气与原空气中的氧气化学性质相同
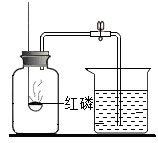
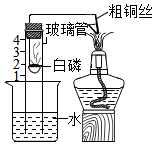
用燃烧磷的方法测出的氧气含量常常远低于21%。
(提出问题)用红磷燃烧的方法测出的氧气含量为什么常常远远偏低?
(进行猜想)可能的原因有①装置漏气;②,装置内氧气有剩余;等……。
(交流与反思)查阅资料得知白磷剧毒、磷燃烧产生的白烟接触水后也有毒。与用红磷、白磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点是,缺点是。
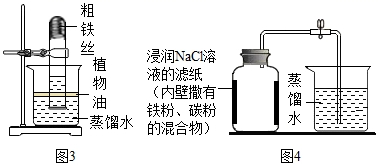
|
实验前的体积/mL |
实验后的体积/mL |
|
|
集气瓶内空气 |
烧杯内蒸馏水 |
烧杯内剩余蒸馏水 |
|
130 |
90.0 |
63.7 |
请列式计算出空气中氧气含量为(计算结果保留一位小数)