反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=kJ/mol
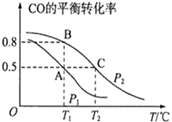
①A、B、C三点的平衡常数KA , KB , KC的大小关系是。
②下列叙述能说明上述反应能达到化学平衡状态的是(填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
微信扫码预览、分享更方便