化学式 | CH3COOH | HCN | H2CO3 |
K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
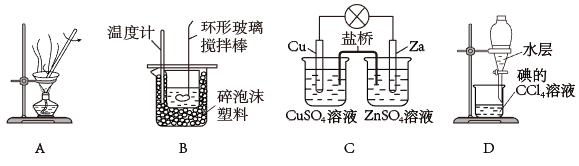
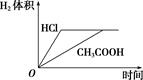
下列说法正确的是( )
| 编组 | A | B | C | D |
| 强电解质 | NaCl | Ba(NO3)2 | H2SO4 | H2S |
| 弱电解质 | HF | CH3COOH | BaSO4 | NH3·H2O |
| 非电解质 | Cu | NH3 | CO2 | 蔗糖 |
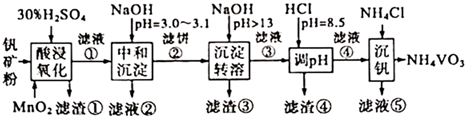
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | | | | | |
| 开始沉淀pH | 1.9 | 7.0 | 8.9 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 10.9 | 4.7 | 10.1 |
下列说法错误的是( )

请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式:.
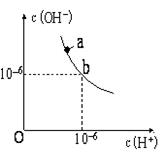
①a、b、c三点对应的溶液中,醋酸电离程度最大的是; 最小的是.
②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A. B.
C.
分子数 D.
①向 溶液中通入少量
:
②向 溶液中滴入少量新制氯水:
(II)BaSO4浊液中存在平衡,其表达式为:
(III)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJ/mol,
③H2O(g)═H2O(l)△H3=﹣44.0kJ/mol
上述三个反应中,△S<0的是.甲醇燃烧生成一氧化碳和液态水的热化学方程式是
(IV)已知碳酸H2CO3:Ka1=4.3×10-7 , Ka2=5.6×10-11
草酸H2C2O4:Ka1=5.9×10-2 , Ka2=6.4×10-5 , 0.1 mol/L Na2CO3溶液的pH0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”),等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是。(选填编号)
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
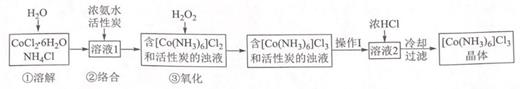
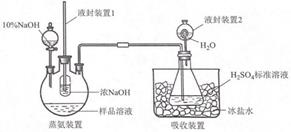
①蒸氨:取 m g 样品进行测定。添加药品后,加热三颈烧瓶,蒸出的 NH3 通入含有V1mLc1 mol•L﹣1H2SO4 标准溶液的锥形瓶中。
液封装置1的作用是
②滴定:将液封装置2中的水倒入锥形瓶后,滴定过剩的H2SO4 , 消耗V2mLC2mol•L﹣1的 NaOH 的标准液产品中 NH3 的质量分数为若未将液封装置 2 中的水倒入锥形瓶,测得 NH3 的质量分数可能(填“偏高”或“偏低”)。
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=kJ/mol
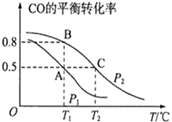
①A、B、C三点的平衡常数KA , KB , KC的大小关系是。
②下列叙述能说明上述反应能达到化学平衡状态的是(填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。
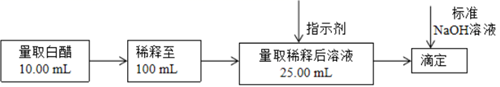

|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00mL |
0.02 |
25.01 |
|
2 |
25.00mL |
0.70 |
25.71 |
|
3 |
25.00mL |
0.50 |
24.2 |
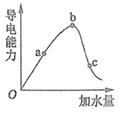
则该白醋(填“符合”或“不符合”)国家标准。