以黄铜矿(CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,原理为:。向上述反应后的溶液中加入Fe粉,发生两个主要反应,得到FeSO4溶液和Cu,
CuFeS2为二硫化亚铁铜,也可以表示为CuS·FeS,其中S元素的化合价为。
【探究二】探究硫酸亚铁晶体受热分解的产物
硫酸亚铁晶体(FeSO4·xH2O)是一种重要的食品和饲料添加剂,对其进行热分解研究。
查阅资料:①硫酸铜粉末为白色,吸水后变成蓝色晶体。
②二氧化硫能使高锰酸钾溶液褪色。
③硫酸亚铁晶体加热会先失去结晶水,高温会继续分解产生一种金属氧化物和两种非金属氧化物。
称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B的质量测出x的值。
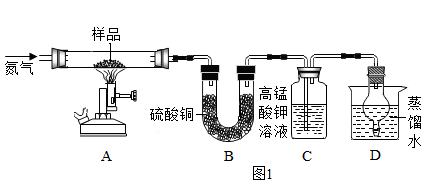
装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有,装置C中高锰酸钾溶液褪色,说明产物中还有;实验前后都要通入氮气。实验后要持续通入氮气,否则测出的x会(填“偏大”“偏小”或“不变”)。
