I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
回答下列问题:

压强p1、P2、P3由大到小的顺序是,判断理由是,压强为P1时,温度高于300℃后,CO2的平衡转化率升高的原因是。
②在温度为T℃下,将1mol CO2和3mol H2充入容积为5L的恒容密闭容器中。同时发生反应I和反应II,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
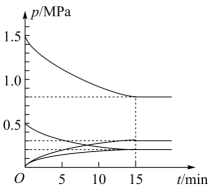
图中缺少了一种组分的分压变化,该组分是(填化学式),该组分平衡时的分压为MPa。0~15min内,反应I的反应速率v(H2)mol·L-1·min-1;T℃时,反应II的平衡常数Kp=(用分压代替浓度)。

①请写出Cu电极上产生HCOOH的电极反应式:。
②如果Cu电极上只生成0.15molC2H4和0.30molCH3OH,则Pt电极上产生O2的物质的量为mol。