选项 | 物质 | 性质 | 用途 |
A. | ClO2 | 强氧化性 | 自来水消毒剂 |
B. | Fe2O3 | 红色 | 油漆中的红色颜料 |
C. | Na2CO3 | 水解显碱性 | 治疗胃酸的药物成分 |
D. | 钛合金 | 耐高温、耐腐蚀 | 制做发动机的火花塞 |

|
|
|
|
A | B | C | D |
下列说法错误的是( )
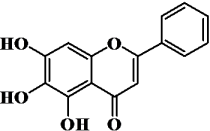
已知:的密度为
, 难溶于水。下列说法错误的是( )
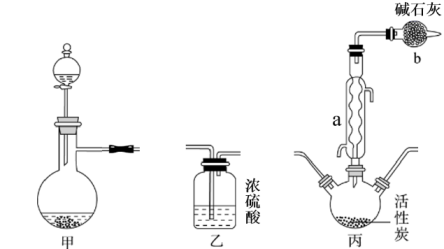
A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3固体
C.浓HNO3+Na2SO3固体 D.70%H2SO4+Na2SO3浓溶液
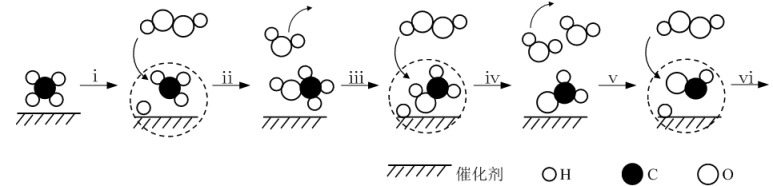
②甲装置中制备Cl2的化学方程式是。

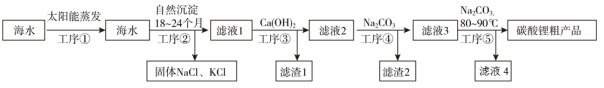
已知:①水碎液中溶质主要成分为Na2SnO3、Na2TeO3、Na3AsO4和Na2PbO2;
②碱性条件下,锡酸钠在水中的溶解度随温度的升高而减小。
回答下列问题:
①取4.0 g碲产品,加入酸使其转化为亚碲酸(H2TeO3),将其配制成100 mL溶液,取20.00 mL于锥形瓶中。
②往锥形瓶中加入20.00 mL0.1 mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。
③用0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴入几滴试亚铁灵指示剂至终点显红色,进行三次平行实验,平均消耗12.00 mL硫酸亚铁铵标准溶液。
计算所得碲产品中碲的纯度为。
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.5kJ·mol-1
回答下列问题:

压强p1、P2、P3由大到小的顺序是,判断理由是,压强为P1时,温度高于300℃后,CO2的平衡转化率升高的原因是。
②在温度为T℃下,将1mol CO2和3mol H2充入容积为5L的恒容密闭容器中。同时发生反应I和反应II,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图所示。
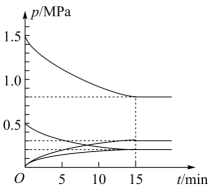
图中缺少了一种组分的分压变化,该组分是(填化学式),该组分平衡时的分压为MPa。0~15min内,反应I的反应速率v(H2)mol·L-1·min-1;T℃时,反应II的平衡常数Kp=(用分压代替浓度)。

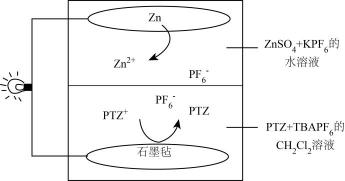
①请写出Cu电极上产生HCOOH的电极反应式:。
②如果Cu电极上只生成0.15molC2H4和0.30molCH3OH,则Pt电极上产生O2的物质的量为mol。
向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:。

①CuS晶体中,相邻的两个铜离子间的距离为pm。
②Cu2S晶体的密度为ρ=g·cm-3(列出计算式即可)。

①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
,
),则原子2和3的坐标分别为、。
①含有饱和六元碳环;②能发生水解反应;③能发生银镜反应