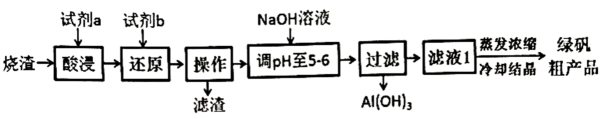
信息提示:①SiO2是酸性氧化物,难溶于水,酸浸时不反应,②Fe(OH)2开始产生沉淀的pH值约为6.3,Al(OH)3开始产生沉淀的pH值约为3.2,完全沉淀pH值约为5.0;回答下列问题:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
步骤三:另取10.00mL溶液A,加入0.0500mol•L-1KMnO4酸性溶液,发生反应:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值(写出计算过程)。