 B . 葡萄糖分子式:C6H12O6
C . 乙烯的结构简式CH2CH2
D . 氮气的结构式:
B . 葡萄糖分子式:C6H12O6
C . 乙烯的结构简式CH2CH2
D . 氮气的结构式:


选项 | 实验操作和现象 | 结论 |
A | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
B | 向试管中加入3mL稀KMnO4酸性溶液,再通入SO2气体,紫红色褪去 | SO2具有漂白性 |
C | 室温下,向 FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
D | 将溶液X与稀盐酸反应产生的气体通入澄清石灰水,石灰水变浑浊 | 溶液X中一定含有CO32- |


①Pt电极(A)是燃料电池的(填“正”或“负”)极,b处通入的是,电池放电时每消耗6.4gCH3OH转移mol电子。②该电池正极上的电极反应式为。
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
Ⅰ | 3mL | 3mL | 0 | 0 | 20 | 2.1 |
Ⅱ | VmL | 3mL | 1.5mL | 0 | 20 | 5.5 |
Ⅲ | 3mL | 3mL | 0 | 0 | 50 | 0.5 |
Ⅳ | 3mL | 3mL | 0 | 少量 | 20 | 0.2 |
请回答:
①设计实验Ⅰ、Ⅲ的目的是;V=mL。
②有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是。



①试剂a作用为。
②导管的作用为。
③分离出E物质的方法是。
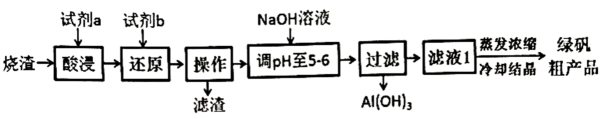
信息提示:①SiO2是酸性氧化物,难溶于水,酸浸时不反应,②Fe(OH)2开始产生沉淀的pH值约为6.3,Al(OH)3开始产生沉淀的pH值约为3.2,完全沉淀pH值约为5.0;回答下列问题:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取10.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体4.660g。
步骤三:另取10.00mL溶液A,加入0.0500mol•L-1KMnO4酸性溶液,发生反应:5Fe2++MnO+8H+=5Fe3++Mn2++4H2O,当两者恰好完全反应时,消耗KMnO4溶液的体积为40.00mL。通过计算确定摩尔盐中x:y的值(写出计算过程)。