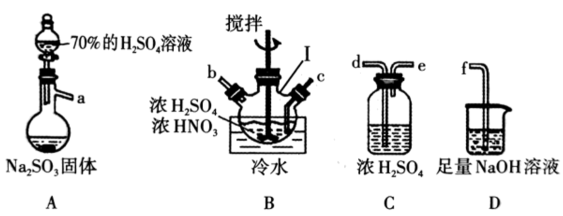
①装置A中发生反应的化学方程式为。 与浓度较低的稀硫酸相比,使用70%的H2SO4溶液除能减少SO2的溶解损耗外,还具有的优点是。
②仪器I的名称是 , 上述装置的连接顺序为:A→→→→。
③混合装置B中浓硫酸和浓硝酸的方法是。
④装置B用冷水浴的目的是。若去掉装置C会使NOSO4H的产量(填“减少”、 “增大”或“不变”)。
步骤1:准确称取14.00g产品,在特定条件下配制成250mL溶液。
步骤2:取25.00mL所配溶液于250mL碘量瓶中,加入60.00mL0.1000mol·L-1KMnO4溶液(过量)和10.00mL 25% H2SO4溶液,然后摇匀。发生反应的方程式为:+ NOSO4H +H2O=Mn2+ +
+
+H+(未配平)
步骤3:用0.2500mol·L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00mL。发生反应的方程式为:2+ 5
+ 6H+= 2Mn2+ + 10CO2↑+ 8H2O
①滴定终点的现象为。
②产品的纯度为%(保留两位有效数字)。