选项 | 目的 | 操作 |
A | 分离乙酸乙酯中少量的乙酸 | 加入适量NaOH溶液,振荡、静置、分液 |
B | 比较Cu(OH)2、Mg(OH)2溶度积的大小 | 向5mL 0.2mol·L-1MgCl2溶液中滴加少量NaOH溶液,待有白色沉淀生成后,再滴加0.2mol·L-1CuCl2溶液 |
C | 比较HCl、H2CO3、H2SiO3的酸性强弱 | 向Na2CO3溶液中加入盐酸,将产生的气体直接通入Na2SiO3 , 溶液中 |
D | 制备较纯净的Cl2 | 将一定量的MnO2粉末与过量的0.1mol/L的盐酸混合加热 |


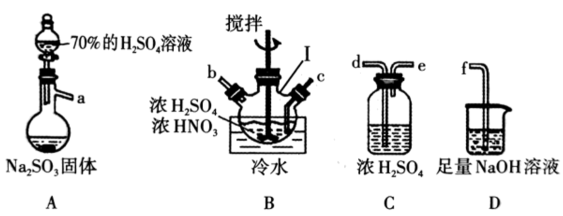
①装置A中发生反应的化学方程式为。 与浓度较低的稀硫酸相比,使用70%的H2SO4溶液除能减少SO2的溶解损耗外,还具有的优点是。
②仪器I的名称是 , 上述装置的连接顺序为:A→→→→。
③混合装置B中浓硫酸和浓硝酸的方法是。
④装置B用冷水浴的目的是。若去掉装置C会使NOSO4H的产量(填“减少”、 “增大”或“不变”)。
步骤1:准确称取14.00g产品,在特定条件下配制成250mL溶液。
步骤2:取25.00mL所配溶液于250mL碘量瓶中,加入60.00mL0.1000mol·L-1KMnO4溶液(过量)和10.00mL 25% H2SO4溶液,然后摇匀。发生反应的方程式为:+ NOSO4H +H2O=Mn2+ +
+
+H+(未配平)
步骤3:用0.2500mol·L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积为20.00mL。发生反应的方程式为:2+ 5
+ 6H+= 2Mn2+ + 10CO2↑+ 8H2O
①滴定终点的现象为。
②产品的纯度为%(保留两位有效数字)。

已知:含镍浸出液中阳离子主要有Ni2+、Fe3+、Cu2+、Ca2+、 Mg2+、Zn2+。常温下,部分物质的溶度积常数如下表:
难溶物 | NiS | ZnS | CuS | CaF2 | MgF2 |
溶度积常数 | 1.07× 10-21 | 2.93 × 10-25 | 1.27 × 10-36 | 4 × 10-11 | 7.42 × 10-11 |
请回答下列问题:
2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的△H=kJ·mol-1

①投料比一定时,要提高N2O平衡转化率,可采取的措施是。
②反应达到平衡前,在同温同压条件下的相同时间段内,N2O的转化率在使用催化剂2时比使用催化剂1要高,原因是。
③在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入1molN2O、4molCO和相同催化剂,发生上述反应。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。
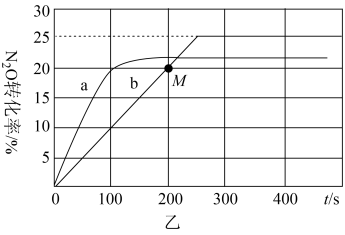
Ⅰ.曲线b中,从反应开始到M点处,用N2O表示的反应速率为mol/(L·s)。
Ⅱ.容器B中N2O的转化率随时间的变化关系是图乙中的(填“a”或“b”)曲线。

①A、B、C三点中NO2的转化率最高的是(填“A”、“B”或“C”)点,理由是。
②C点时该反应的压强平衡常数Kp=MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

图1
①C16S8分子中C原子和S原子的杂化轨道类型分别为、。
②测得C16S8中碳硫键的键长介于C-S键和C=S键之间,其原因可能是。

 的路线:。
的路线:。