已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2O(g) CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=。
·p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
在540K下,按初始投料比n(CO2):n(H2)=3:l、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:

①比较a、b、c各曲线所表示的投料比大小顺序为(用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,
p(H2)=0.4MPa,此时v正:v逆=。
3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如下图中曲线a所示,已知Arrhenius经验公式为R lnk=
(Ea为活化能,k为速率常数,R和C为常数)

①该反应的活化能Ea=kJ·mol-1。
②当使用更高效催化剂时,在图中画出R lnk与 关系的示意图。
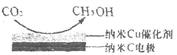
阴极的电极反应式为。