1.
(2022·运城模拟)
为改变能源结构和缓解环境压力,对甲烷等传统化石燃料的深度处理和综合利用成为当今研究的热点之一。甲烷催化制乙炔的反应体系中主要涉及如下反应:
I.2CH4(g) C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
II.CH4(g) C(s)+2H2(g) ΔH2=+75kJ·mol-1;
C(s)+2H2(g) ΔH2=+75kJ·mol-1;
III.CO2(g)+C(s) 2CO(g) ΔH3=+172kJ·mol-1;
2CO(g) ΔH3=+172kJ·mol-1;
IV.CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=+41kJ·mol-1。
CO(g)+H2O(g) ΔH4=+41kJ·mol-1。
回答下列问题:
-
(1)
CH
4(g)+H
2O(g)

CO(g)+3H
2(g)ΔH=
。
-
-
(2)
一定温度下,Kc(III)=0.1mol·L-1、Kc(IV)=0.2(Kc是用平衡浓度表示的平衡常数),向恒容密闭容器中充入一定量CH4和CO2 , 5min末达到平衡时测得反应体系中c(CO):c(H2O)=5:1。则5min末,容器内H2的平衡浓度c(H2)=mol·L-1。
-
-
(3)
反应中催化剂活性会因反应II而降低,同时反应III又会消除催化剂表面的积碳。催化剂表面生成碳的速率方程为v=

(其中k表示速率常数),则一定温度下,减少催化剂表面积碳量的措施为
。
-
-
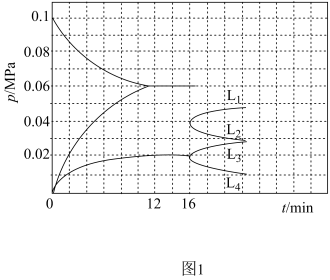
(4)
一定温度下,将2molCH
4充入5L恒容密闭容器中发生反应I,实验测得反应前容器内压强为0.1MPa,容器内各气体分压与时间的关系如图1所示。该温度下,反应I的平衡常数K
c=
mol
2·L
-2;16min时改变容器容积,图1中能表示C
2H
2的分压与时间变化关系的曲线为
(填“L
1”“L
2”“L
3”或“L
4”),原因为
。
-
-
(5)
有学者结合实验和计算机模拟结果,报道了如图2所示的反应IV的一种反应历程,其中吸附在催化剂表面的物种用“●”标注。反应速率最大的步骤对应的化学方程式为
;TS3对应的步骤适合在
(填“高温”或“低温”)条件下进行。

-
C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
C(s)+2H2(g) ΔH2=+75kJ·mol-1;
2CO(g) ΔH3=+172kJ·mol-1;
CO(g)+H2O(g) ΔH4=+41kJ·mol-1。

