

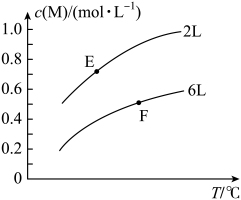

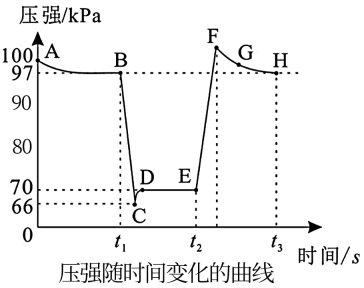
下列说法错误的是( )
 B .
B .  C .
C .  D .
D . 

反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58.6kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ·mol-1
0.5MPa下,将n(H2):n(CO2)=3的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、CH3OH或CO的选择性[×100%]以及CH3OH的收率(CO2的转化率×CH3OH的选择性)随温度的变化如图所示。下列说法正确的是( )


反应Ⅰ 2CH3I(g)C2H4(g)+2HI(g)
反应Ⅱ 3C2H4(g)2C3H6(g)
反应Ⅲ 2C2H4(g)C4H8(g)
向容积为1L的密闭容器中起始投入1molCH3I(g),反应温度对平衡体系中乙烯、丙烯和丁烯占所有气体物质的量分数的影响如图所示。已知715K时,CH3I的转化率为80%。

下列说法正确的是( )

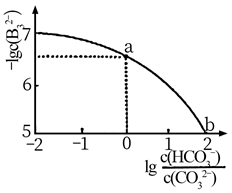
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
SO2(g)+O2(g)
SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。


①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。
①
②
反应③的
, 平衡常数
(用
表示)。
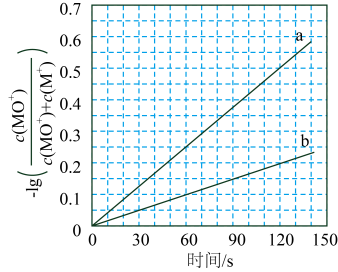

(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与
反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与
反应,氘代甲醇的产量
(填“>”“<”或“=”)。若
与
反应,生成的氘代甲醇有种。
A.低温低压B.低温高压C.高温低压D.高温高压

①下列说法正确的是。
A.可循环利用,
不可循环利用
B.过程ⅱ,吸收
可促使
氧化
的平衡正移
C.过程ⅱ产生的最终未被
吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原需吸收的能量更多
②过程ⅱ平衡后通入 , 测得一段时间内
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升的原因。
①常压下和
按物质的量之比
投料,某一时段内
和
的转化率随温度变化如图1,请在图2中画出
间R的变化趋势,并标明
时R值。

②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
|
温度/℃ |
480 |
500 |
520 |
550 |
|
|
7.9 |
11.5 |
20.2 |
34.8 |
|
R |
2.6 |
2.4 |
2.1 |
1.8 |
下列说法错误的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中占比越高
C.温度升高,转化率增加,
转化率降低,R值减小
D.改变催化剂提高转化率,R值不一定增大

已知
则的
(用
、
、
表示)。

①下列说法正确的是
A.b点时:2v正(H2)=3v逆(H2O)
B.a、b、c三点的平衡常数:Ka>Kc>Kb
C.将H2O(g)液化分离可提高C2H4的产率
D.活性更高的催化剂可提高CO2的平衡转化率
②表示C2H4体积分数随温度变化的曲线是(填“k”“l”“m”或“n”)
③若d点表示240℃某时刻H2的体积分数,保持温度不变,则反应向(填“正”或“逆”)反应方向进行。
④205℃,反应达b点所用时间为tmin,则此过程中用CO2表示的反应速率是mol/min。若平衡时b点总压为P,则平衡常数Kp=(列出计算式,以分压表示,分压=总压×物质的量分数)。
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如下图所示。使用催化剂X,当温度高于302℃,CO2转化随着温度升高而下降的原因是。

温度(K) | 起始反应物的量(mol) | 平衡时 | |
500 | 0.40 | 0.10 | 0.02 |
600 | 0.40 | 0.10 | 0.03 |
该反应是(选填“吸热”或“放热”)反应;500K时,反应5min时达到平衡,则0~5min内,的平均反应速率
;600K时,达到平衡所需时间(选填“大于”“小于”或“等于”)5min。
a. b.
c.COS d.

请解释产率先增大后减小的原因。

请写出与
反应的离子方程式;在上述吸收过程中,理论上无需添加的物质是。
①CO2(g)+CH4(g)⇌2H2(g)+2CO(g) -Q1(Q1大于0)
②CO2(g)+H2(g)⇌H2O(g)+CO(g) -Q2(Q2大于0)
在容积固定的某密闭容器中,反应物投料比按n(CO2):n(CH4)=1:1发生上述反应,CO2、CH4的平衡转化率随温度变化的曲线如图所示。

根据消耗情况可以判断:图中曲线(选填“A”或“B”)表示CO2的平衡转化率随温度的变化趋势。提高CH4的平衡转化率的措施为(列举一条)。
向ZnO悬浊液中缓缓通入SO2 , SO2吸收率及溶液pH变化如图所示。已知:ZnSO3微溶于水,Zn(HSO3)2易溶于水。

在0~10min,溶液pH几乎保持不变,该阶段主要产物为(填化学式);在30~40min,SO2吸收率迅速降低,该阶段主要反应的离子方程式为。

①其他条件不变,x的值增大,的平衡转化率减小的原因是。
②T1(填“>”、“<”或“=”)T2。
③T2℃时,该反应的平衡常数(只列计算式,不带单位)。提示:分压=总压×气体物质的量分数。

 B .
B .  C .
C .  D .
D . 

①图中对应等压过程的曲线是(填“M”或“N”),判断依据是。
②x=时,N2的转化率为,此时反应条件为或。
反应I: CO2(g) +3H2(g)CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
反应: II.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
当原料组成为n(CO2):n(H2)=1:3时,上述反应体系在一定条件下建立平衡后,含碳产物中CH3OH的物质的量分数(Y)及CO2的转化率(Q )与反应温度的关系曲线如图所示。
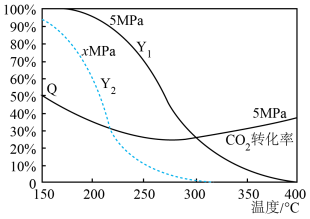
图中A,B,C,D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为T1时,反应II的化学平衡常数K=。

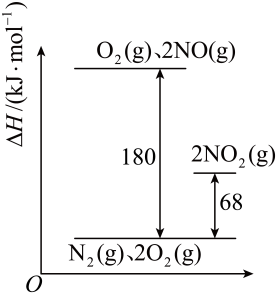
I.2NO(g)+O2(g)⇌2NO2(g) K1=3. 3×1013
II.2NO(g)⇌N2(g)+O2(g) K2=2. 2× 1030
则该温度下,反应III:2NO2(g)⇌N2(g)+2O2(g) K3= (计算结果保留一位小数),反应II与反应III相比分解趋势较大的反应是(填“反应II”或“反应III ”)。
序号 | c(NO)/(mol·L-1) | c(H2)/ (mol·L-1) | v正/(mol·L-1·min-1) |
I | 0.10 | 0.10 | 0.414k正 |
II | 0.10 | 0.20 | 0.828k正 |
III | 0.30 | 0.10 | 3.726k正 |
①v正 =k正cm(NO)·cn(H2)中,m=、n=。
②经研究,有人提出上述反应分两步进行: I. 2NO(g)+ H2 (g)=N2 (g) + H2O2(g);II. H2(g)+H2O2(g)=2H2O(g)。化学总反应由较慢的一步反应决定。上述反应中II反应较快,则反应I正反应活化能 (填“大于”“小于”或“等于”)反应II正反应活化能。

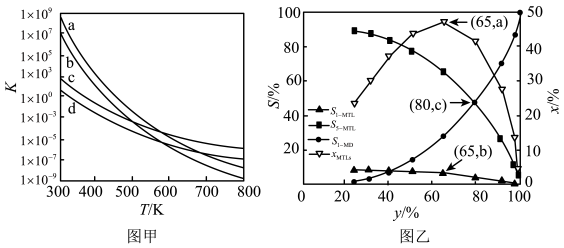
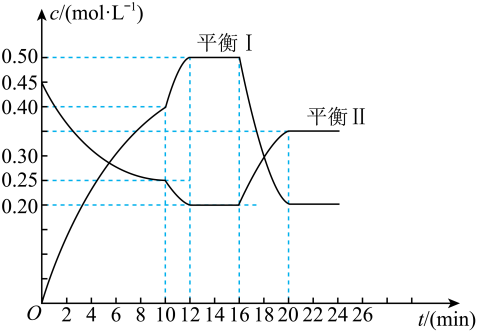
①c、d分别为反应R1和R3的平衡常数随温度变化的曲线,则表示反应R2的平衡常数随温度变化曲线为。
②已知反应R1的速率方程v正=k正•c(1-MN)•c2(H2),v逆=k逆•c(5-MTL)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。温度T1下反应达到平衡时k正=1.5k逆 , 温度T2下反应达到平衡时k正=3k逆。由此推知,T1T2(填“>”,“<”或“=”)。
③下列说法错误的是。
A.四个反应均为放热反应 B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1-MD最稳定 D.由上述信息可知,400K时反应R4速率最快

①催化效率,Cat2(填“>”、“<”或“=”)Catl。
②a点(填 “达到”或 “未达到”)平衡,理由是。b点之后CO2的转化率降低,可能的原因是。

①p2 (填 “>”、 “<”或 “=”)p1 , 随着温度升高,不同压强下,CO2的平衡转化率接近相等,其主要原因是。
②已知M点对应的容器体积为1 L,则在300℃下平衡常数K=(只列计算式)。

①反应开始后的16小时内,在第种催化剂作用下,收集的CH4较多。
②0~20小时(h)内,在第Ⅰ种催化剂作用下,O2的平均生成速率v(O2)=。实验测得当温度高于560℃,O2的平均生成速率明显下降,原因可能是。
已知:a. C(s) + 2H2(g) ⇌CH4(g) ΔH1
b. 2H2(g) + O2(g) = 2H2O(g) ΔH2
c. 2C(s) + O2(g) = 2CO(g) ΔH3
①反应CH4(g)+H2O(g)⇌ CO(g)+3H2(g)的ΔH= 。
②下列说法中,无法说明该反应达到平衡状态的是(填字母)。
a.CH4体积分数不再变化 b.气体的压强不再变化
c.体系的密度保持不变 d.消耗1 mol CH4同时消耗3 mol H2
③一定温度时,在体积为2 L的恒容密闭容器中,充入0.25 mol的CH4和0.25 mol的水蒸气发生以上反应。测得CH4平衡时的转化率与温度、压强的关系如图2所示,则p1 p2 (填“>”“<”或“=”);温度为1100 ℃时,y点的浓度平衡常数K=。

I.2CH4(g)C2H2(g)+3H2(g) ΔH1=+376.6kJ·mol-1;
II.CH4(g)C(s)+2H2(g) ΔH2=+75kJ·mol-1;
III.CO2(g)+C(s)2CO(g) ΔH3=+172kJ·mol-1;
IV.CO2(g)+H2(g)CO(g)+H2O(g) ΔH4=+41kJ·mol-1。
回答下列问题:

