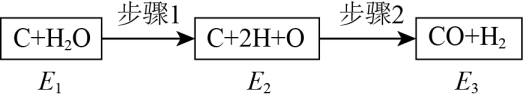
CH3OH(g) +CO(g)= CH3COOH(g) △H1
CH3OH(g) +CO(g) +2H2(g)=CH3CH2OH(g) +H2O(g) △H2
又知乙醇氧化为乙酸的反应为:CH3CH2OH(g) +O2 (g)= CH3COOH(g) +H2O(g) △H3
则2H2 (g) +O2(g)= 2H2O(g) △H = (用△H1、△H2、△H3表示)。
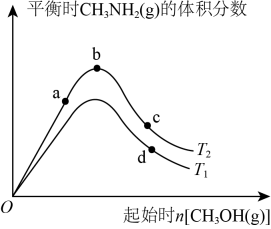
①据图分析T1T2(填“>”、“<”或“=”);
②图中(填“a”、“ b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。
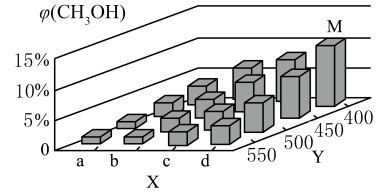
①下列不能判断该反应达到化学平衡状态的是(填字母)。
A.体系中气体的总质量保持不变
B.CO的消耗速率与CH3OH的消耗速率相等、
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②X轴上a点的数值比b点(填“大”或“小”)。图中Y轴表示的外界条件为 ,判断的理由是
③在M点所处的温度(T3℃)和压强(p0 kPa)下,反应经20 min达到平衡时 (CH3OH) =10% ,该温度下反应的平衡常数Kp =kPa-2(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。