


选项 | 实验操作 | 实验目的 |
A | 向1mL0.1mol/ LMgSO4溶液中加入1mL0.3mol/L KOH溶液,再滴5-6滴0.1mol/LCuSO4溶液,观察现象 | 比较Ksp[Cu(OH)2]、Ksp[ Mg(OH)2 ]的大小 |
B | 用石墨电极电解Mg(NO3)2和Cu(NO3)2的混合液 | 比较铜和镁的金属活动性强弱 |
C | 室温下用pH试纸测0.1mol/L NaClO溶液和0.1mol/LCH₃COONa溶液中的pH | 比较CH3COOH和HClO的酸性强弱 |
D | 向2支试管中分别加入同体积、同浓度的Na2S2O3 , 溶液,再分别加入同体积、不同浓度的稀硫酸,分别放入冷水和热水中 | 探究温度对反应速率的影响 |

编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |


①第一步反应是(填“放热”或“吸热”)反应
②1mol NH(aq)全部氧化成NO
(aq)热化学方程式为。
P4(白磷,s)+5O2(g) =2P2O5(s) △H1
4P(红磷,s)+5O2(g) =2P2O5(s) △H2
△H1△H2(填写“>”、“<”或“=”)
化学键 | P-P | P-O | O=O | P=O |
键能(KJ·mol-1) | 197 | 360 | 499 | x |
已知:P4(s) +5O2(g)=P4O10(s) △H=-2378.0 kJ·mol-1 , 白磷(P4)及P4O10的结构如图,则x=

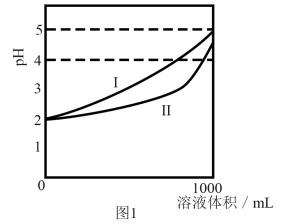
①图中能代表H2C2O2溶液稀释情况的是曲线(填“I”或“II”)。
②在稀释该溶液过程中,下列物理量始终增大的是(填字母)。
A. B.c(H+)·c(C2O
) C.
D.

①试分析图中E、F、G三点,水的电离程度最大的是点。
②下列关系式正确的是(填字母)。
a.E点存在:2c(Na+)=3c(H2C2O4) +3c(H2C4O)+3c(C2O
)
b.F点存在:c(H+ )=c (OH- )+c(HC2O)+c(H2C2O4)
c. G点对应的溶液中,c(Na+ )>c(OH- )>e(HC2O )>c(H2C2O4 )
用标准Na2CO3溶液滴定该稀盐酸时,Na2CO3溶液应装在如图的(填“甲”或“乙”)滴定管中,原因是(用离子方程式表示)。

已知:实验中加入盐酸的目的是将Na2S2O5全部转化成SO2。
实验达到滴定终点的标志是。
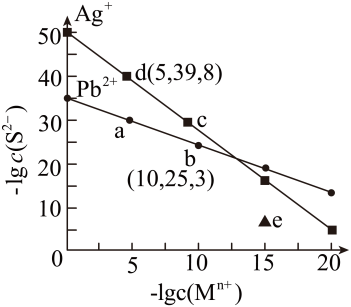
参考下表数据,若用AgNO3 , 滴定NaSCN溶液,可选用的指示剂是____(填字母)
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.211×10-16 | 1.12×10-12 | 1.0×10-12 |

图1
①电池中,Zn为极(填“正”或“负"), PbO2电极的电极反应为
②B区域的电解质为(填“K2SO4”、“H2SO4”或 “KOH”);阳离子交换膜为图中的膜(填“a”或“b”)。
③此电池维持电流强度0.5A(相当于每秒通过5x10-6mol电子),连续工作80分钟即接近失效。如果制造该电池所需的锌粉为6g,则电池失效时仍有 %的金属锌未参加反应。

①图中装置为 (填“原电池"或“电解池),a、b均为石墨电极,b极的电极反应式为。
②M为 (填“阴高子/或“阳离子”)交换膜。
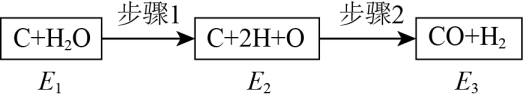
CH3OH(g) +CO(g)= CH3COOH(g) △H1
CH3OH(g) +CO(g) +2H2(g)=CH3CH2OH(g) +H2O(g) △H2
又知乙醇氧化为乙酸的反应为:CH3CH2OH(g) +O2 (g)= CH3COOH(g) +H2O(g) △H3
则2H2 (g) +O2(g)= 2H2O(g) △H = (用△H1、△H2、△H3表示)。
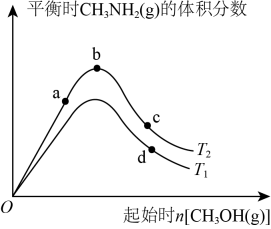
①据图分析T1T2(填“>”、“<”或“=”);
②图中(填“a”、“ b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。
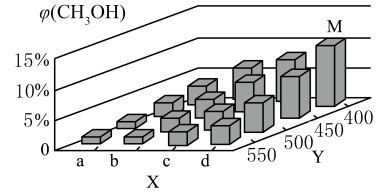
①下列不能判断该反应达到化学平衡状态的是(填字母)。
A.体系中气体的总质量保持不变
B.CO的消耗速率与CH3OH的消耗速率相等、
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②X轴上a点的数值比b点(填“大”或“小”)。图中Y轴表示的外界条件为 ,判断的理由是
③在M点所处的温度(T3℃)和压强(p0 kPa)下,反应经20 min达到平衡时 (CH3OH) =10% ,该温度下反应的平衡常数Kp =kPa-2(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。