1.
(2021高一上·西城期末)
高铁酸钾(K2FeO4)是一种新型净水剂,制备流程如下:
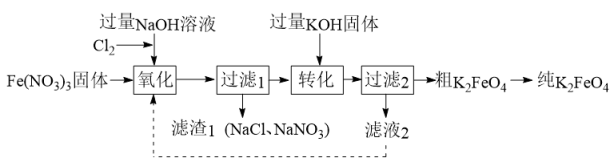
资料:Ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇。KOH易溶于乙醇。
Ⅱ.FeO 在碱性溶液中稳定,中性和酸性溶液中不稳定。
在碱性溶液中稳定,中性和酸性溶液中不稳定。
-
(1)
K2FeO4具有强氧化性,其中铁元素的化合价为价。
-
-
(2)
Cl2与NaOH溶液反应生成NaClO的离子方程式是。
-
-
(3)
补全“氧化”中反应的离子方程式:
ClO− + Fe3+ + _= FeO_+ _ + _
-
-
(4)
下列说法正确的是
。
a.“氧化”中NaOH溶液过量的目的是使FeO 稳定存在
稳定存在
b.“转化”中生成K2FeO4固体
c.设计物质循环的目的是提高原料的利用率
-
-
(5)
粗K2FeO4转化为纯K2FeO4的操作包含洗涤,去除固体表面的KOH,可以用洗涤。
-
-
(6)
K
2FeO
4与稀硫酸反应生成Fe
3+和O
2 , 通过测定生成O
2的体积,可计算K
2FeO
4的纯度。[M(K
2FeO
4)=198 g/mol]取m g K
2FeO
4产品与稀硫酸反应,测得生成O
2的体积为v mL(标准状况)。
①计算K2FeO4的纯度=(列算式)。( )
)
②若将稀硫酸换成稀盐酸,生成的气体中含有Cl2 , 导致K2FeO4的纯度的计算值偏大,原因是。
-

在碱性溶液中稳定,中性和酸性溶液中不稳定。
稳定存在
)