已知:①实验室制备原理为PCl3+SO2+Cl2 POCl3+SOCl2
②资料卡片:
|
物质 |
熔点/℃ |
沸点/℃ |
相对分子质量 |
其他 |
|
PCl3 |
-112 |
76.1 |
137.5 |
遇水剧烈水解,易与O2反应 |
|
POCl3 |
1.25 |
105.8 |
153. 5 |
遇水剧烈水解,能溶于PCl3 |
|
SOCl2 |
-105 |
78.8 |
119 |
遇水剧烈水解,受热易分解 |
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
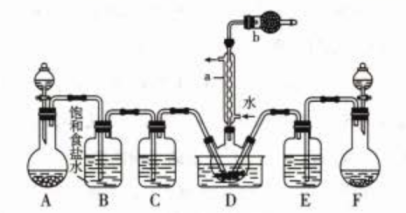
反应制取,则上图中制取Cl2的装置为(填字母)。
实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量m1g,迅速加入0.6 mLSOCl2样品,立即盖紧,称量,质量为m2g。
②连同称量瓶一起放入盛有300 mL NaOH溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放人冰水浴,浸泡水解1 h后,将水解瓶中的溶液全部转移到500 mL.容量瓶中,洗涤水解瓶2~3次,洗涤液一并转 人容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取50.00 mL.溶液M于250 ml碘量瓶中,加入两滴指示剂,用2 mol·L-1的盐酸中和过量的NaOH溶液至恰好完全。
④准确加入50.00 mL 0.0500 mol·L-1碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
0.1000 mol·L-1的Na2S2O3溶液滴定过量的碘,反应为I2+2Na2S2O3=Na2S4O6+2Nal。平行测定两次,反应消耗Na2S2O3溶液的平均体积为V mL。
A.实际碘标准溶液浓度偏低
B.实际Na2S2O3溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成