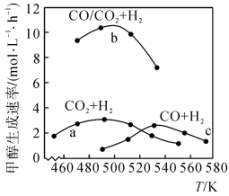
I.CO(g)+2H2(g)=CH3OH(g) △H1=-129.0kJ•mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41kJ•mol-1
III.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3
回答下列问题:
H3=。
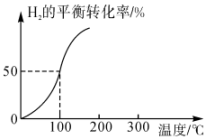
①100℃时反应II达到平衡所需的时间为5min,则反应从起始至5min内,用H2表示该反应的平均反应速率为。
②100℃时,反应II的平衡常数K=。
③其他条件不变时,下列措施可以提高反应II的化学反应速率的是(填标号)。
A.恒容条件下通入He B.增大容器体积
C.升高温度 D.通入更多的H2(g)
④已知:反应II的瞬时速率表达式为v正=k正c(CO2)•c(H2),v逆=k逆c(CO)•c(H2O)(k为速率常数,只与温度有关)。温度由100℃升高到300℃,活化分子百分数(填“增大”“减小”或“不变”)。300℃时,(填“大于”“小于”或“等于”)K(100℃)。