1.
(2022高二上·沂水期中)
某小组为测定I-(aq)+I2(aq) I
I (aq)的平衡常数,完成实验I和实验II。
(aq)的平衡常数,完成实验I和实验II。
已知:i.2Na2S2O3+I2=Na2S4O6+2NaI
ii.I-与I 难溶于CCl4
难溶于CCl4
iii.室温下,达到溶解平衡后,I2在CCl4层和水层中的分配比 为常数
为常数
实验I:测定分配比

-
(1)
在2Na2S2O3+I2=Na2S4O6+2NaI中,I2作剂(填“氧化”或“还原”)。
-
-
(2)
I2易溶于CCl4的原因是,分液操作用到的主要玻璃仪器有、烧杯。
-
-
-
-
(4)
实验测得分配比为86:1,则V1:V2=。
-
-
(5)
实验II:测定平衡常数
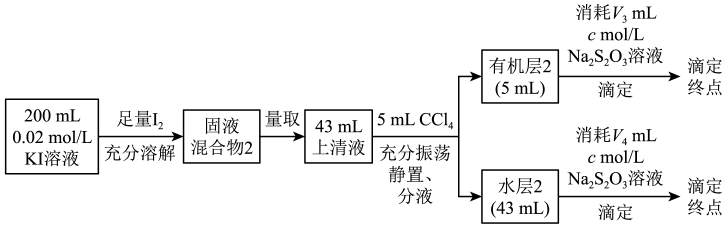
通过V4可推知水层2中I2和I 的总浓度,结合平衡移动原理解释原因:。
的总浓度,结合平衡移动原理解释原因:。
-
-
(6)
通过实验I和实验II,测得平衡常数K=(用含c、V3、V4的代数式表示,可以不化简)。
-
难溶于CCl4
为常数


的总浓度,结合平衡移动原理解释原因:。