反应①:O3→O2+O• (快)
反应②:O3+O•→2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl•)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
CO(g)+O2(g)=CO2(g) ΔH2=-283kJ/mol
理论上2mol石墨不充分燃烧,生成等物质的量的CO(g)和CO2(g)放出的热量是( )
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略
ⅱ.Fe3++4Cl-[FeCl4]-(黄色)

下列说法错误的是( )
①
②
其他条件不变时,在相同时间内温度对催化加氢的影响如图。

下列说法错误的是( )
①锌粉加入后,发生的反应有Zn+2H+=Zn2++H2↑、。
②“过滤”、“洗涤”操作会导致所测得的n(Fe2+)偏低的原因有。
已知:i.2Na2S2O3+I2=Na2S4O6+2NaI
ii.I-与I难溶于CCl4
iii.室温下,达到溶解平衡后,I2在CCl4层和水层中的分配比为常数
实验I:测定分配比

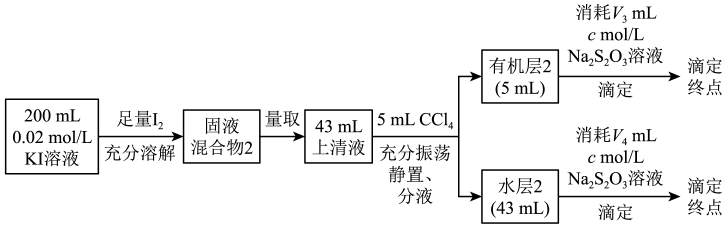
通过V4可推知水层2中I2和I的总浓度,结合平衡移动原理解释原因:。
①用硫酸和可溶解软锰矿,请补全该反应的离子方程式:
□+□ +□ =□
+□
□
②浸出时可用代替硫酸和
。下列说法正确的是(填序号)。
a.在反应中作氧化剂
b.用浸出可减少酸的使用
c.该法可同时处理烟气中的 , 减少大气污染
①软锰矿浸出液中的、
可通过加碱转化为沉淀去除,分离出清液的方法是。
②为减少碱用量,可以通过稀释浸出液除去 , 结合离子方程式解释原理:。
在一定空气流速下,相同时间内热解产物中不同价态
的占比随热解温度的变化如图。
热解过程中涉及如下化学反应:
i.
ii.
iii.

①为了增大产物中的占比,可以采用的措施是(答出两条)。
②温度升高,产物中的占比降低,可能的原因是。

芳构化反应:6CH4(g) C6H6(g)+9H2(g) ΔH1
积碳反应:CH4(g) C(s)+2H2(g) ΔH2
若要用ΔH1计算ΔH2 , 则还需要利用反应的ΔH。

①ΔH10(填“>”或“<”)
②P1、P2的大小关系是,理由是。

该反应历程中,催化剂使决速步骤的活化能降低eV。

①根据图中曲线分析,的催化剂催化效果最好(填“催化剂I”“催化剂II”“催化剂III”)
②下列措施有利于提高转化为
的平衡转化率的有(填字母序号)
A.恒容条件下充入不参与反应的
B.选择催化效率更高的催化剂
C.在达到平衡后的体系中移出部分(g)
D.保持反应容器的体积不变,平衡时再充入2.0mol (g)和6.0mol
(g)
③温度在之后,使用不同的催化剂,二氧化碳转化率相同的原因是。
反应I:
反应II:
①。
②其他条件相同的情况下,测得的平衡转化率随温度变化关系如图所示,
的平衡转化率随温度变化先下降后升高,温度高于T后的平衡转化率随温度升高而升高的原因为。

③一定条件下,向体积为2L的恒容密闭容器中通入2molCO2 和6molH2发生上述三个反应,达到平衡时,容器温度中CH3OH(g)为x mol,CO为y mol,反应I的平衡常数为(用含x、y的代数式表示)。