反应Ⅰ:
反应Ⅱ:
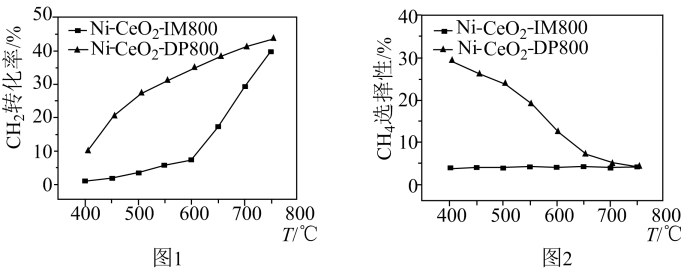
①图1中,选用Ni-CeO2-IM800催化剂时,CO2(g)的转化率在温度高于600℃后迅速增大,解释其原因为。
②600℃时,为提高CO(g)的产率,适宜选择的催化剂为(填“Ni-CeO2-IM800”或“Ni-CeO2-DP800”),解释其原因为。

①图中表征压强为0.1 MPa的是(填“L1”“L2”或“L3”)。温度升高,三条曲线逐渐靠近的主要原因为。
②Q点时,测得CH4(g)的物质的量为b mol。则该温度下,反应Ⅰ的平衡常数K=(用含a、b的代数式表示)。