

①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。

实验测得A室混合气体的质量为34 g,若将A室H2、O2的混合气体点燃,恢复原温度后,(非气体体积忽略不计)最终活塞停留的位置在刻度处。
①若测得2h后的浓度为0.6
, 此时间内
的消耗速率为0.2
, 则开始时
的浓度为
。
②将0.050mol (g)和0.030mol
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
。计算该条件下反应的平衡常数K=,
的平衡转化率为。
③可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为。

反应 | 活化能 | 平衡常数 | |
Ⅰ | |||
Ⅱ |
|
恒容、恒温()条件下,反应体系中
随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的原因:。

Ⅱ.
①由和
生成
和
的热化学方程式为。
②的
(填“>”“<”或“=”)0,从化学键的角度说明判断的理由:。
| 各含碳产物占所有含碳产物的物质的量分数/% | ||
其他 | |||
60.0 | 60.0 | 40.0 | 0 |
反应达到平衡后,的分压是kPa(气体的分压=气体总压×该气体的物质的量分数,结果保留三位有效数字,下同),从反应开始到平衡时,
的反应速率是
。

其中铁的配位数为;Fe2Cl6属于非极性分子的原因为。



①化合物X的晶体类型是,X的化学式为。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:
请从温度和压强两个角度分析利于NO2吸附的条件。
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=。
利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
b.
c.
d.
①反应d的历程如下图所示。该历程中最大活化能E正=kJ/mol。

②保持其他条件不变,随着的增加,SO2脱除效率的逐渐增加的原因是。

反应I:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=-41.1kJ•mol-1
化学键 | H-H | C | O-H | C=O |
键能/(kJ•mol-1) | 436 | 1071 | 464 | 803 |
②若K1、K2分别表示反应I、反应Ⅱ的平衡常数,则CO(g)+2H2(g)CH3OH(g)的平衡常数K=(用含K1、K2的代数式表示)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇

①科学上规定:在298.15K时,由最稳定的单质生成1mol某纯物质时的焓变,叫做该物质的标准摩尔生成焓();最稳定的单质的标准摩尔生成焓规定为零。已知:部分物质的标准摩尔生成焓数据如表(单位:
):
物质 | | | | | | |
| -46.1 | 0 | 90.3 | -241.8 | 33.2 | 11.1 |
则上述该反应的=。
②下列说法错误的是(填标号)。
a.当混合气体的平均摩尔质量不变时,反应达到平衡
b.当时,反应达到平衡
c.反应过程中分离出 , 正反应速率增大
d.平衡时,若的转化率为60%,则a=5

①前10min内用表示的平均化学反应速率为。
②反应②的为(分压=总压×物质的量分数)。
③甲同学绘制出如图所示平衡后四种气体在平衡体系中的体积分数随温度的变化情况。

乙同学认为曲线b不可能表示氢气的体积分数,原因是
Ⅰ.NONO*
Ⅱ.2NO*ON-NO*
Ⅲ.
Ⅳ.ON-NO-CO*ON-N*+CO2;
Ⅴ.。
ⅰ. 快速平衡
ⅱ. 慢反应
ⅲ. 快反应
ⅳ. 快反应
反应ⅳ的反应式为;反应Ⅰ逆反应的决速步骤是(填反应序号)。
①为提高的平衡转化率,除改变温度外,还可以采取的措施是。
②恒温恒容条件下,起始时和
的浓度分别为
和
, 达平衡时
和
的浓度分别为
和
。达平衡时,
的浓度是
, 反应Ⅰ的平衡常数K是。(用含a、b、c、d的代数式表示)
③在该温度下,反应Ⅲ的标准平衡常数。[已知:分压=总压×该组分物质的量分数,对于反应
,
, 其中
,
为各组分的平衡分压]

压强由大到小的顺序为,体系温度未达到时,
物质的量分数几乎为0的原因是。

该反应历程中,使用催化剂条件下的决速步骤的反应方程式为:。

①Y点对应的温度和压强为℃、kPa。
②M点时容器中为
, CO为
, 反应①的压强平衡常数
(压强平衡常数
是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
③图中M点的高于N点的原因是。
2H2S(g) +3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ ·mol-1
H2S(g)+
SO2(g)=S2(g)+
H2O(g) ΔH2=b kJ ·mol-1
2H2S(g)+O2(g)=2S(g) +2H2O(g) ΔH3=c kJ ·mol-1
则2S(g)=S2(g) △H4= kJ ·mol-1

①图中表示H2S、H2变化的曲线分别是 、。反应达平衡的标志是(填标号)。
A.2v正(H2S)=4v逆(H2)
B.CH4的体积分数不再变化
C. 不再变化
D.混合气体的密度不再改变
②由图可知该反应的ΔH0(填“>”“<”或“=”),判断的理由是 。
③M点对应温度下,CH4的转化率为 ;950℃时该反应的Kp= ( MPa)2。
I.
II.
III.
回答下列问题:

则反应历程中决速步骤的反应方程式为。

①250℃后,随温度升高,平衡时混合气体的平均相对分子质量几乎不变的原因是。
②T℃时,反应的初始压强为 , 平衡时甲醇的选择性(生成甲醇消耗的
在
总消耗量中占比)为,反应I的平衡常数
(
为以分压表示的平衡常数,分压=总压×物质的量的分数)。若再向密闭容器中通入
和
, 使二者分压均增大
, 则
的转化率(填“增大”“减小”或“不变”)。
A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:AlMg(填“>”或“<”),其原因是。


中心离子提供空轨道的能级是;H、C、Cl、Br电负性由大到小的顺序为;C、N原子的杂化方式共有种。该配合物中H-N-H键角为109.5°,而NH3分子中H-N-H键角为107°,原因是。

A点原子的分数坐标为(),则B点原子的分数坐标是。该晶胞中距离最近的两个Zn原子间的长度为anm,设NA为阿伏加德罗常数的值,则ZnO晶体的密度为g·cm-3(用代数式表示)。

反应I.
反应II.
反应III.
某压强下在体积固定的密闭容器中,按照投料发生反应I、II、III。平衡时,CO、
在含碳产物中物质的量分数及
转化率随温度的变化如图所示。

n曲线代表的物质为。
②在150~250℃范围内,转化率随温度升高而降低的原因是。

①研究表明,图中过程ii的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是。
A.对该反应有阻碍作用
B.其它物种的存在削弱了同一吸附位上H的吸附
C.温度变化导致活化能增大
D.温度变化导致平衡常数减小
②已知:图中HCOO为甲酸物种,结构是 ,
,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。

该反应历程中,催化剂使决速步骤的活化能降低eV。

①根据图中曲线分析,的催化剂催化效果最好(填“催化剂I”“催化剂II”“催化剂III”)
②下列措施有利于提高转化为
的平衡转化率的有(填字母序号)
A.恒容条件下充入不参与反应的
B.选择催化效率更高的催化剂
C.在达到平衡后的体系中移出部分(g)
D.保持反应容器的体积不变,平衡时再充入2.0mol (g)和6.0mol
(g)
③温度在之后,使用不同的催化剂,二氧化碳转化率相同的原因是。
反应I:
反应II:
①。
②其他条件相同的情况下,测得的平衡转化率随温度变化关系如图所示,
的平衡转化率随温度变化先下降后升高,温度高于T后的平衡转化率随温度升高而升高的原因为。

③一定条件下,向体积为2L的恒容密闭容器中通入2molCO2 和6molH2发生上述三个反应,达到平衡时,容器温度中CH3OH(g)为x mol,CO为y mol,反应I的平衡常数为(用含x、y的代数式表示)。

①该条件下,制备甲醇选取的最佳温度约为K。
②随着温度的升高,该密闭容器中甲醇浓度先增大后减小的原因是。

①图2中,表示反应
的是直线(填“甲”或“乙”)。
②计算1250K时,反应的平衡常数
。
③在图3中补充完成
反应过程中的能量变化曲线。

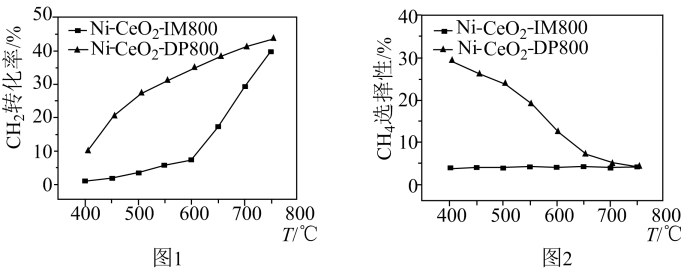
①图1中,选用Ni-CeO2-IM800催化剂时,CO2(g)的转化率在温度高于600℃后迅速增大,解释其原因为。
②600℃时,为提高CO(g)的产率,适宜选择的催化剂为(填“Ni-CeO2-IM800”或“Ni-CeO2-DP800”),解释其原因为。

①图中表征压强为0.1 MPa的是(填“L1”“L2”或“L3”)。温度升高,三条曲线逐渐靠近的主要原因为。
②Q点时,测得CH4(g)的物质的量为b mol。则该温度下,反应Ⅰ的平衡常数K=(用含a、b的代数式表示)。
①该温度下,反应I用物质的量浓度表示的平衡常数KC为。(保留3位有效数字)。
②平衡时丙烯的选择性为(C3H6的选择性=100%)。

①恒温下,将1mol丙烷以恒定的流速依次逐个通过三个相同装置,下图是丙烯的产率随着时间的变化阶段一、二、三的图像,其中阶段二图像是(填标号)。

②温度对丙烷脱氢反应的影响见下图:
项目 | 530℃ | 550℃ | 580℃ | 600℃ | 620℃ | 640℃ |
丙烷转化率% | 17.67 | 27.85 | 32.54 | 46.35 | 53.19 | 57.28 |
丙烯选择性% | 88.64 | 84.38 | 71.16 | 69.65 | 63.79 | 48.26 |
将1mol丙烷以恒定的流速通过不同温度相同反应的装置,主反应适宜的温度范围是。


则:升高温度,反应I速率的增大程度(填“大于”、“等于”或“小于”)反应II速率的增大程度。
I. CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) ΔH1 = −49 kJ∙mol−1
II. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2= −24.5 kJ∙mol−1
III. CO2(g)+H2(g) CO(g)+ H2O(g) ΔH3= +41.2 kJ∙mol−1
回答下列问题:

已知:二甲醚选择性=表示平衡时CH3OCH3选择性的曲线是 (填“X”或“Y” );温度高于300℃时,曲线X的纵坐标随温度升高而增大的原因是。