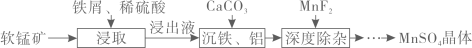
已知:常温下,一些金属氢氧化物沉淀时的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.5 | 6.5 | 7.7 | 3.8 |
| 沉淀完全pH | 3.7 | 9.7 | 9.8 | 5.2 |
常温下,一些难溶电解质的溶度积常数如下表:
| 难溶电解质 | MnF2 | CaF2 | MgF2 |
| KSp | 5.3×10-3 | 51.5×10-10 | 7.4×10-11 |
回答下列问题: