 C . 离子半径:Cu2+>Cl->S2-
D . 新制的Cu(OH)2悬浊液可用于尿液中葡萄糖的检验
C . 离子半径:Cu2+>Cl->S2-
D . 新制的Cu(OH)2悬浊液可用于尿液中葡萄糖的检验
|
实验 |
现象 |
结论 |
|
|
A |
向2 mL0.1 mol·L-1KI溶液中滴加5滴0.1 mol·L-1的FeCl3溶液,振荡,再滴加1~2滴KSCN溶液 |
溶液呈血红色 |
FeCl3与KI的反应是可逆反应 |
|
B |
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 |
集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
CO2具有氧化性 |
|
C |
加热乙醇与浓硫酸的混合溶液,将产生的气体通入少量酸性KMnO4溶液 |
溶液紫红色褪去 |
有乙烯生成 |
|
D |
向5 mL0.1 mol·L-1ZnSO4溶液中加入1 mL0.1 mol·L-1 Na2S溶液,再滴加几滴CuSO4溶液 |
先有白色沉淀生成,后转化为黑色沉淀 |
Ksp(CuS)<Ksp(ZnS) |
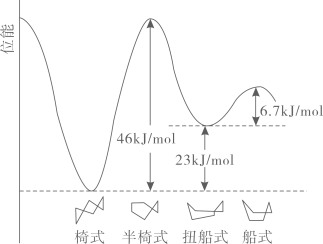
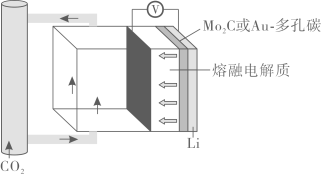

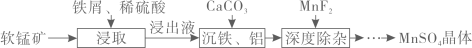
已知:常温下,一些金属氢氧化物沉淀时的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.5 | 6.5 | 7.7 | 3.8 |
| 沉淀完全pH | 3.7 | 9.7 | 9.8 | 5.2 |
常温下,一些难溶电解质的溶度积常数如下表:
| 难溶电解质 | MnF2 | CaF2 | MgF2 |
| KSp | 5.3×10-3 | 51.5×10-10 | 7.4×10-11 |
回答下列问题:
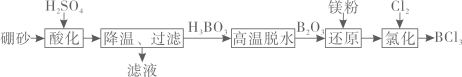
回答下列问题:
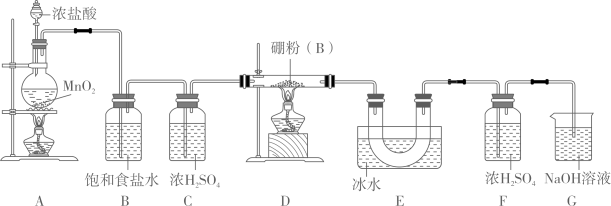
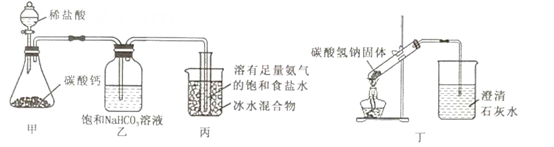
①装置A中发生反应的离子方程式为。
②实验时,如果拆去B装置,可能的后果是。
③为使实验装置简便,可用一个装置代替F和G装置,该装置的名称是,所装试剂是。
④实验时先点燃A处酒精灯,一段时间后再点燃D处酒精灯,其理由是。

已知:①A的相对分子质量为76,1 mol A与足量Na反应生成1 mol H2 , 且核磁共振氢谱中有3组峰;
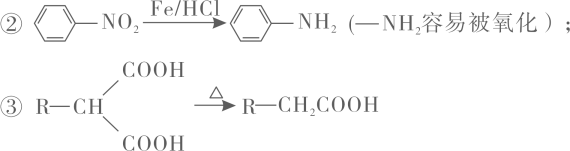
回答下列问题:
①能发生水解反应,水解产物之一是α-氨基酸;
②核磁共振氢谱有6组峰,且峰面积之比为3:2:2:2:1:1。
 为原料,设计制备
为原料,设计制备 的合成路线:(无机试剂任选)。
的合成路线:(无机试剂任选)。
在恒压密闭容器中,起始充人2 mol CO2(g)和6 mol H2(g)发生反应,该反应在不同的温度下达到平衡时,各组分的体积分数随温度的变化如图1所示。

①图中表示CO2的体积分数随温度变化的曲线是(填字母)。357℃时可以证明反应达到平衡状态的标志为(填字母)。
a. v正(CO2)=2v逆(H2O)
b.容器中H2的体积分数保持不变
c.混合气体的密度保持不变
②A、B、C三点对应的化学平衡常数分别为KA、KB、KC , 则三者从大到小的排列顺序为。
③B点反应达到平衡后,CO2的平衡转化率为(计算结果保留一位小数),若平衡时总压为P,则平衡常数Kp=(列出计算式,以分压表示,气体分压=总压×气体的物质的量分数)。

使用催化剂X,当温度高于320℃时,CO2的转化率逐渐下降,其原因是 。根据图像,(填“能”或“不能”)计算280℃时该反应的平衡常数,其理由是。
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1=-49 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41kJ·mol-1
则CO(g)和H2(g)反应生成CH3OH(g)的热化学方程式为。