
回答下列问题:
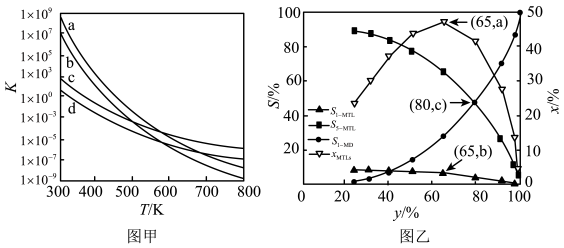
①c、d分别为反应R1和R3的平衡常数随温度变化的曲线,则表示反应R2的平衡常数随温度变化曲线为。
②已知反应R1的速率方程v正=k正•c(1-MN)•c2(H2),v逆=k逆•c(5-MTL)(k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。温度T1下反应达到平衡时k正=1.5k逆 , 温度T2下反应达到平衡时k正=3k逆。由此推知,T1T2(填“>”,“<”或“=”)。
③下列说法错误的是。
A.四个反应均为放热反应 B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中1-MD最稳定 D.由上述信息可知,400K时反应R4速率最快