已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= , 写出此反应的热化学方程式:。
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
①a=kJ·mol-1 , 改变下列“量”,一定会引起ΔH发生变化的是(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
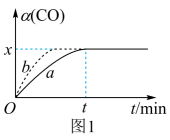
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是加入催化剂或者。
②在此温度下,该可逆反应的平衡常数K=(用含x的代数式表示)。