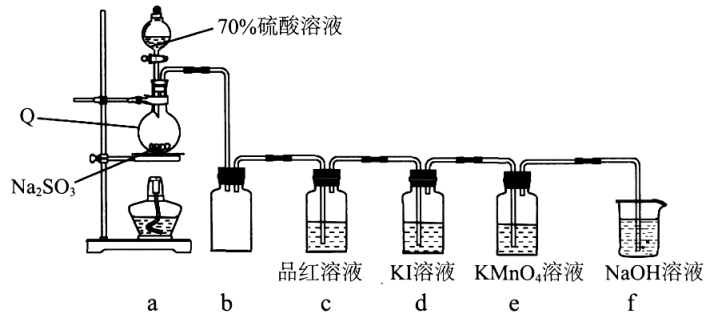
回答下列问题:
探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素 | 编号 | 操作 | 现象 |
c(I—) | i | 取50mL①于锥形瓶中,向其中通入20mL SO2 | 溶液变为浅黄色 |
ii | 取50mL 1.0mol·L-1 KI溶液于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄 | |
c(H+) | iii | 取50mL 1.0mol·L-1 KI溶液和5mL ②于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄 |
iV | 取50mL 1.0mol·L-1 KI溶液和5mL 浓盐酸于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄,且出现乳黄色浑浊 |
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案 | 操作 | 预期现象 | 结论 |
i | 取适量装置d中浊液,向其中滴加几滴③溶液(填试剂名称),振荡 | 无明显变化 | 浊液中无I2 |
ii | 将装置d中浊液进行分离 | 得淡黄色固体和澄清溶液 | |
取适量分离后的澄清溶液于试管中,④ . | 白色沉淀 | ⑤ |
⑥综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为。