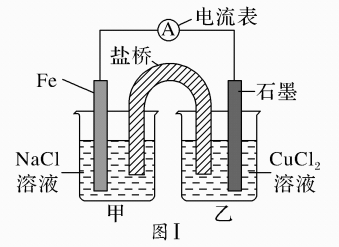
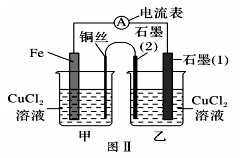
Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,下列结论正确的是( )
选项 | 操作或做法 | 目的 |
A | 向两只盛有2mL5%双氧水的试管中,分别滴加5滴饱和 | 探究催化剂对反应速率的影响 |
B | 取5mL0.1mol/LKI溶液于试管中,加入 | 探究KI与 |
C | 用玻璃棒蘸取NaClO溶液点到干燥的pH试纸中间 | 测NaClO溶液的pH值 |
D | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 | 取20.00mL盐酸 |
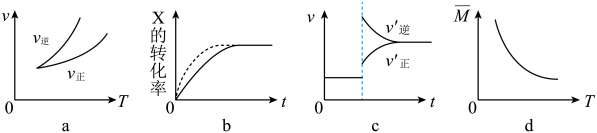
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka1=1.77×10-4 | Ka1=4.9×10-10 | Ka1=4.3×10-7 ; Ka2=5.6×10-11 |
下列选项错误的是( )
变化。
C . 该催化剂可有效提高反应物的平衡转化率 D . 容易得到的副产物有CO和CH2O,其中相对较多的副产物为CO探究I:探究浓度对上述可逆反应的影响
有同学认为除SO2的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(SO2体积已折算为标准状况下体积)。
限选试剂:0.1 mol·L-1KI溶液、1.0mol·L-1KI溶液、2.0mol·L-1KI溶液、蒸馏水、浓硝酸、浓盐酸
影响因素 | 编号 | 操作 | 现象 |
c(I—) | i | 取50mL①于锥形瓶中,向其中通入20mL SO2 | 溶液变为浅黄色 |
ii | 取50mL 1.0mol·L-1 KI溶液于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄 | |
c(H+) | iii | 取50mL 1.0mol·L-1 KI溶液和5mL ②于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄 |
iV | 取50mL 1.0mol·L-1 KI溶液和5mL 浓盐酸于锥形瓶中,向其中通入20mL SO2 | 溶液迅速变黄,且出现乳黄色浑浊 |
有同学提出上述可逆反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO42-+2I-+4H+.为进一步探究体系中的产物,完成下列实验方案。
方案 | 操作 | 预期现象 | 结论 |
i | 取适量装置d中浊液,向其中滴加几滴③溶液(填试剂名称),振荡 | 无明显变化 | 浊液中无I2 |
ii | 将装置d中浊液进行分离 | 得淡黄色固体和澄清溶液 | |
取适量分离后的澄清溶液于试管中,④ . | 白色沉淀 | ⑤ |
⑥综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为。
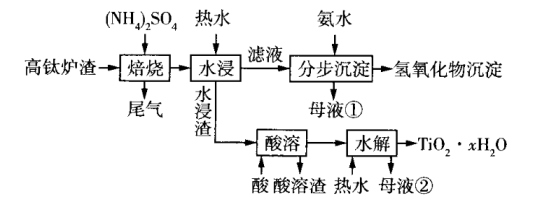
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH如表所示。
金属离子 | ||||
开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全 | 3.2 | 4.7 | 11.1 | 13.8 |
回答下列问题:

用浓度分别为2.0 mol·L-1、2.5 mol·L-1、3.0 mol·L-1的HNO3溶液进行了三组实验,得到c([FeR3]2+)随时间t的变化曲线如图。
①图中对应c(HNO3) = 3.0 mol·L-1时的变化曲线为(填代号III、II、I)。
②c(HNO3) = 3.0 mol·L-1时,在0~1min内,[FeR3]3+的平均消耗速率= mol/(L·min)。
③下列有关说法中,正确的有。
A.平衡后加水稀释,增大
B.[FeR3]2+的平衡转化率:αIII>αII>αI
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:tIII>tII>tI
i).M(aq)+L (aq) ML(aq) K1
ii).ML(aq)+L(aq) ML2(aq) K2
研究组配制了M与L起始浓度比c0(M)/c0(L)不同的系列溶液,反应平衡后测定L的含量,测得起始浓度比c0(M)/c0(L)分别为0、a、b时,各成分L的含量S如下表(各成分含L的总量S计为1).

【注】:“<0.01”表示未检测到。
①c0(M)/c0(L)=a时, x=。
②c0(M)/c0(L)=b时,平衡浓度比c平(ML2)/c平(ML)=