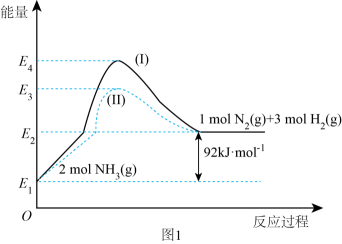
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为。
②过程(Ⅰ)和过程(Ⅱ)的反应热(填“相同”或“不同”)。
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8。
a.该温度下的平衡常数为。(只列计算式)
b.N2的平衡转化率为。
反应Ⅰ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=(用含a、c的代数式表示),K3=(用K1和K2表示)。
a.N2的浓度不再改变
b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化
d.混合气体的密度保持不变